
Structuur, functies en remmers van acetylcholinesterase
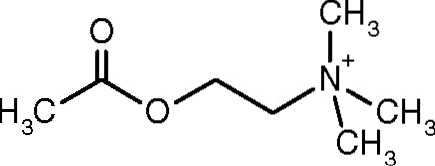
De acetylcholinesterase (acetylcholine-acetylhydrolase, EC 3.1.1.7) is een enzym dat voornamelijk in het centrale zenuwstelsel wordt aangetroffen. Zijn taak, zoals de naam al aangeeft, is de hydrolytische verwerking van de neurotransmitter acetylcholine..
Het is een enzym dat is geassocieerd met het celmembraan dat samenwerkt met de acetylcholinereceptor om de excitatie van postsynaptische cellen te mediëren en waarvan het katalytische mechanisme verrassend snel is..
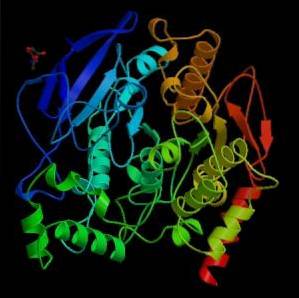
Vanuit mechanisch oogpunt kan dit enzym worden gezien als een serinehydrolase, en in het katalytische domein van zijn actieve plaats bevat het de triade van aminozuren die kenmerkend zijn voor serineproteasen: serine, histidine en een zuur residu. Het zure residu is echter een glutamaat, terwijl de serineproteasen normaal gesproken een aspartaat bezitten..
Een van de eerste waarnemingen die de katalytische activiteit van acetylcholinesterase in verband bracht met cholinerge zenuwweefsels en spierweefsels, werd gedaan door Dale in 1914; later is vastgesteld dat het ook aanwezig is in niet-cholinerge neuronen en in hematopoëtische, osteogene en neoplastische cellen.
Dankzij de studie van verschillende organismen is het momenteel bekend dat het enzym aanwezig is in het membraan van verschillende soorten cellen zoals erytrocyten, zenuw- en spiercellen, elektrische organen en andere..
Artikel index
- 1 Structuur
- 1.1 Tertiaire en quartaire structuur
- 1.2 Primaire structuur
- 2 functies
- 3 remmers
- 3.1 Onomkeerbare remmers
- 3.2 Omkeerbare remmers
- 3.3 Butyrylcholinesterase
- 4 Acetylcholinesterase en de ziekte van Alzheimer
- 5 referenties
Structuur
Tertiaire en quartaire structuur
Onder natuurlijke omstandigheden of "in vivo ", acetylcholinesterase is een polymorf enzym dat is samengesteld uit verschillende katalytische subeenheden van ongeveer 80 kDa, die zich samenvoegen om een oligomere structuur te vormen (van verschillende subeenheden).
De hoeveelheid en complexiteit van deze subeenheden hangt af van het celtype en de beschouwde soort..
Enkele van de meer complexe enzymvormen hebben katalytische subeenheden met bolvormige (G) of asymmetrische (A) vormen die zijn verbonden door disulfidebruggen. Disulfidebruggen zijn covalente bindingen die worden gevormd tussen twee zwavelmoleculen van de thiolgroepen (-SH) van twee residuen van het aminozuur cysteïne.
Elke G-subeenheid bevat een enkele actieve plaats, terwijl de A-subeenheden over het algemeen worden gekenmerkt door drie structurele domeinen, namelijk: katalytische subeenheden, collageenachtige staarten die rijk zijn aan glycine-, hydroxyproline- en hydroxylysineresiduen, en andere. Niet-collageenlijmen (anders dan collageen).
De asymmetrische vormen van acetylcholinesterase staan bekend als A12, A8 en A4, die respectievelijk 12, 8 en 4 katalytische subeenheden hebben..
Over het algemeen worden de residuen van het katalytische domein op de actieve site gevonden in een "diep" gebied van de subeenheden, wat als tegenstrijdig kan worden gezien met betrekking tot de hoge reactiesnelheid die dit enzym katalyseert en de schijnbare ontoegankelijkheid van het substraat. naar deze sites..
Ongeacht het polymorfisme van het enzym, hebben zowel globulaire als asymmetrische subeenheden vergelijkbare katalytische activiteiten..
Varianten
Sommige andere cellen dan zenuwcellen, zoals erytrocyten, produceren overwegend bolvormige, dimere acetylcholinesterase-enzymen, meestal geassocieerd met de buitenkant van het plasmamembraan..
Het erytrocytenzym, hoewel minder structureel complex, is ook een amfipatisch enzym, waarvan het actieve katalytische domein wordt aangetroffen in het grote hydrofiele gebied, terwijl het hydrofobe domein, dat het carboxyl-terminale gebied bevat, verantwoordelijk is voor het in stand houden van het in het membraan..
Primaire structuur
Veel van de huidige kennis over de sequentie van acetylcholinesterase kwam voort uit de studie van het enzym Californica torpedo, een pijlstaartrog die in de Stille Oceaan leeft en van oudsher wordt gebruikt als modelorganisme voor de studie van verschillende eiwitten van het zenuwstelsel.
Acetylcholinesterase-subeenheden worden gesynthetiseerd als pro-eiwitten die vervolgens worden verwerkt om rijpe subeenheden te doen ontstaan. Elke subeenheid bestaat uit een polypeptide van ongeveer 575 aminozuren en een molecuulgewicht van 65 kDa, dat wordt verhoogd door de toevoeging van 7-8% koolhydraatresten (glycosylering)..
De katalytische activiteit van de actieve plaats van de subeenheden wordt bepaald door een serineresidu op positie 200, dat wordt aangetroffen in een "diep" gebied van de katalytische subeenheden..
Verschillende varianten of isovormen van het enzym bestaan in organismen dankzij verschillende locaties voor de "alternatieve splitsing " van de pre-boodschapper-RNA's aan beide uiteinden (5 'en 3'). De carboxyl-terminale sequentie van de isovorm van elke subeenheid bepaalt de samenstelling van de oligomeren met elkaar..
Kenmerken
Acetylcholinesterase is een enzym met meerdere biologische functies die niet noodzakelijkerwijs met elkaar verband houden. Feit bevestigd door zijn differentiële expressie tijdens embryogenese, embryonale neurale extensie, spierontwikkeling en synaptogenese.
Zoals hierboven benadrukt, speelt het een belangrijke rol bij de snelle hydrolyse van acetylcholine en dus bij de regulering van het effect ervan in de neuromusculaire synaptische ruimte of in de cholinerge synaptische ruimtes van het centrale zenuwstelsel..
Een voorbeeld van zijn functies is de samentrekking van skeletspieren, die optreedt dankzij een soort chemische synaps die bekend staat als een motorplaat, die zich tussen een motorneuron en een spiervezel bevindt..
Honderden met acetylcholine beladen blaasjes worden bij deze synaps bereikt, die worden vrijgegeven uit het motorneuron voor de voortplanting van een elektrische impuls..
Dit neurotransmissieproces is vrij complex, maar de deelname van acetylcholinesterase is cruciaal voor de beëindiging van de synaptische transmissie die afhangt van de neurotransmitter acetylcholine, aangezien het moet worden afgebroken en vervolgens buiten de synaptische spleet moet diffunderen om te culmineren in de membraanexcitatie..
Het enzym acetylcholinesterase is dus verantwoordelijk voor het reguleren van de concentratie van deze zender in de neuromotorische synaps..
Andere "niet-klassieke" functies van het enzym zijn gerelateerd aan neuritogenese of groei van zenuwcellen; met de processen van celadhesie, synaptogenese, activering van neuronen-dopamine in de substantia nigra van de middenhersenen, hematopoietische processen en poietische trombus, onder anderen.
Remmers
Acetylcholinesteraseremmers werken door te voorkomen dat het acetylcholine hydroliseert, waardoor het niveau en de werkingsduur van deze neurotransmitter toenemen. Ze kunnen volgens hun werkingsmechanisme worden geclassificeerd als omkeerbaar en onomkeerbaar.
Onomkeerbare remmers
Zij zijn degenen die de hydrolytische activiteit van acetylcholinesterase onomkeerbaar remmen door zijn covalente binding aan het serineresidu op de actieve plaats van het enzym. Deze groep bestaat voornamelijk uit de organofosfaten.
Over het algemeen zijn dit actieve verbindingen die in veel insecticiden aanwezig zijn en verantwoordelijk zijn voor een groot aantal sterfgevallen door accidentele vergiftiging. Het zijn esters of thiolen die zijn afgeleid van fosforzuur, fosfonzuur, fosfinezuur of fosforamidezuur.
Sarin, tabun, soman en cyclosarine behoren tot de meest giftige verbindingen die door de mens worden gesynthetiseerd, aangezien ze een mens kunnen doden door ademhalings- en circulatiestoornissen te induceren door acetylcholinesterase in het perifere zenuwstelsel te blokkeren..
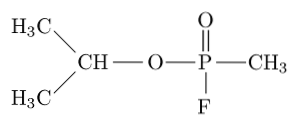
Sarin is bijvoorbeeld een 'zenuwgas' dat is gebruikt als chemisch wapen voor terroristisch gebruik..
Omkeerbare remmers
Deze volgorde van classificatie groepeert competitieve en niet-competitieve remmers die werken door voorbijgaande en reversibele carbamylering van een serineresidu in de actieve plaats en vele zijn gesynthetiseerd en gezuiverd uit planten- of schimmelbronnen..
Carbamaten zoals fysostigmine en neostigmine zijn reversibele remmers die worden gebruikt als geneesmiddelen voor de behandeling van ziekten zoals respectievelijk glaucoom en myasthenia gravis..
Andere therapeutische middelen in deze groep worden ook gebruikt voor de behandeling van de ziekte van Alzheimer, de ziekte van Parkinson, postoperatieve darmobstructies (postoperatieve ileus), opgezette blaas en als tegengif voor anticholinergische overdosering..
Butyrylcholinesterase
Een interessant natuurlijk mechanisme tegen sommige acetylcholinesteraseremmende stoffen heeft te maken met de deelname van een minder specifiek enzym dat bekend staat als butyrylcholinesterase..
Dit enzym is ook in staat acetylcholine te hydrolyseren en tegelijkertijd kan het fungeren als een moleculaire lokvogel die reageert met deze gifstoffen voordat ze hun negatieve effect op acetylcholinesterase uitoefenen..
Acetylcholinesterase en de ziekte van Alzheimer
Van acetylcholinesterase is aangetoond dat het een stabiel complex vormt met de componenten van de seniele plaques die kenmerkend zijn voor de pathologie. Bovendien zijn enkele veranderde glycosylatiepatronen van dit enzym in verband gebracht met de aanwezigheid en vorming van amyloïde plaques in de hersenen..
Veel van de reversibele acetylcholinesteraseremmers zijn daarom gebruikt als geneesmiddelen van de eerste generatie voor de behandeling van deze ziekte en andere gerelateerde neurodegeneratieve aandoeningen. Deze omvatten donepezil, rivastigmine en galantamine..
Referenties
- Dvir, H., Silman, I., Harel, M., Rosenberry, T. L., & Sussman, J. L. (2010). Acetylcholinesterase: van 3D-structuur naar functie. Chemisch-biologische interacties, 187, 10-22.
- Houghton, P., Ren, Y., en Howes, M. (2006). Acetylcholinesteraseremmers uit planten en schimmels. Natuurlijke productrapporten, 2. 3, 181-199.
- Krsti, D. Z., Lazarevi, T. D., Bond, A. M., & Vasi, V. M. (2013). Acetylcholinesteraseremmers: farmacologie en toxicologie. Huidige neurofarmacologie, elf, 315-335.
- Mukherjee, P. K., Kumar, V., Mal, M., & Houghton, P. J. (2007). Acetylcholinesteraseremmers uit planten. Fytomedicine, 14, 289-300.
- Quinn, D. M. (1987). Acetylcholinesterase: enzymstructuur, reactiedynamica en virtuele overgangstoestanden. Chem Rev., 87, 955-979.
- Racchi, M., Mazzucchelli, M., Porrello, E., Lanni, C., & Govoni, S. (2004). Acetylcholinesteraseremmers: nieuwe activiteiten van oude moleculen. Farmacologisch onderzoek, vijftig, 441-451.
- Rosenberry, T. (1975). Acetylcholinesterase. Vooruitgang in de enzymologie en aanverwante gebieden van moleculaire biologie, 43, 103-218.
- Soreq, H., & Seidman, S. (2001). Acetylcholinesterase - nieuwe rollen voor een oude acteur. Nature beoordelingen, twee, 294-302.
- Talesa, V. N. (2001). Acetylcholinesterase bij de ziekte van Alzheimer. Mechanismen van veroudering en ontwikkeling, 122, 1961-1969.


Niemand heeft nog op dit artikel gereageerd.