
Adenylaatcyclase kenmerken, typen, functies
De adenylaatcyclase of adenylcyclase is het enzym dat verantwoordelijk is voor de omzetting van ATP, een hoogenergetisch molecuul, in cyclisch AMP, een belangrijk signaalmolecuul dat verschillende cyclisch afhankelijke AMP-eiwitten met belangrijke fysiologische functies activeert.
Zijn activiteit wordt gecontroleerd door verschillende factoren, zoals bijvoorbeeld de gecoördineerde werking van hormonen, neurotransmitters en andere regulerende moleculen van verschillende aard (tweewaardige calciumionen en G-eiwitten, om er maar een paar te noemen)..
Het belangrijkste belang van dit enzym ligt in het belang van het product van de reactie die het katalyseert, cyclisch AMP, omdat het deelneemt aan de controle van vele cellulaire verschijnselen die verband houden met metabolisme en ontwikkeling, evenals de reactie op verschillende externe stimuli..
In de natuur gebruiken zowel eencellige organismen (relatief eenvoudig) als grote en complexe meercellige dieren cyclisch AMP als tweede boodschapper, en dus de enzymen die het produceren..
Fylogenetische studies hebben aangetoond dat deze enzymen afkomstig zijn van een gemeenschappelijke voorouder voorafgaand aan de scheiding van eubacteriën en eukaryoten, wat suggereert dat cyclisch AMP verschillende functies had, mogelijk gerelateerd aan ATP-productie..
Het is mogelijk om een dergelijke verklaring te accepteren, aangezien de reactie die wordt gekatalyseerd door adenylaatcyclase gemakkelijk omkeerbaar is, wat kan worden opgemerkt bij de evenwichtsconstante voor ATP-synthese (Keq ≈ 2,1 ± 0,2 10-9 M.twee.
Artikel index
- 1 Kenmerken en structuur
- 1.1 Structurele kenmerken
- 1.2 Katalytische site
- 1.3 Locatie
- 2 soorten
- 2.1 Zoogdier adenylaatcyclasen
- 3 functies
- 4 Verordening
- 5 referenties
Kenmerken en structuur
De meeste eukaryote adenylaatcyclase-enzymen zijn geassocieerd met het plasmamembraan, maar in bacteriën en zoogdierlijke spermacellen worden ze aangetroffen als oplosbare eiwitten in het cytosol..
In gist en sommige bacteriën zijn het perifere membraaneiwitten, terwijl het bij bepaalde soorten amoeben moleculen zijn met een enkel transmembraansegment.
Structurele kenmerken
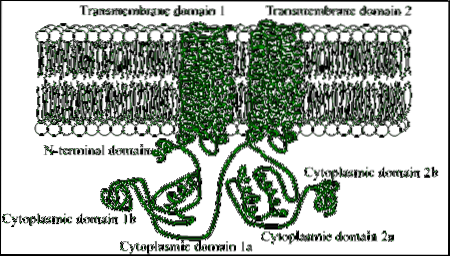
Het zijn eiwitten die zijn samengesteld uit grote polypeptideketens (van meer dan 1000 aminozuurresiduen), die het plasmamembraan 12 keer doorkruisen door twee gebieden die zijn samengesteld uit zes transmembraandomeinen van alfa-helixconformatie..
Elk transmembraangebied wordt gescheiden door een groot cytosolisch domein, dat verantwoordelijk is voor katalytische activiteit..
Onder eukaryote organismen bevinden zich enkele geconserveerde motieven in een fragment van het amino-terminale gebied van deze enzymen, evenals een cytoplasmatisch domein van ongeveer 40 kDa, dat wordt begrensd door de hydrofobe secties..
Katalytische site
De reactie die deze enzymen katalyseren, dat wil zeggen de vorming van een diesterbinding door een nucleofiele aanval van de OH-groep op positie 3 'op de fosfaatgroep van het nucleoside trifosfaat op positie 5', hangt af van een gemeenschappelijk structureel motief dat bekend staat als de domein Palm ".
Dit domein van "palm" is samengesteld uit een motief "βαβααβ"(" Β "betekent de β-gevouwen vellen en" α "de alfa-helices) en heeft twee onveranderlijke asparaginezuurresiduen die de twee metaalionen coördineren die verantwoordelijk zijn voor katalyse, die tweewaardige magnesium- of magnesiumionen kunnen zijn. Zink.
Veel studies met betrekking tot de quaternaire structuur van deze enzymen hebben aangetoond dat hun katalytische eenheid bestaat als een dimeer waarvan de vorming afhangt van de transmembraansegmenten die tijdens de vorming van het eiwit in het endoplasmatisch reticulum samenkomen..
Plaats
Er is vastgesteld dat, net als veel integrale membraaneiwitten, zoals G-eiwitten, die met fosfatidylinositolankers en vele andere, adenylcyclasen worden aangetroffen in speciale membraangebieden of microdomeinen die bekend staan als 'lipidevlotten' (uit het Engels "Lipidevlot".
Deze membraandomeinen kunnen honderden nanometers in diameter zijn en zijn voornamelijk samengesteld uit cholesterol en sfingolipiden met lange en overwegend verzadigde vetzuurketens, waardoor ze minder vloeibaar zijn en transmembraansegmenten van verschillende eiwitten kunnen huisvesten..
Adenylaatcyclasen zijn ook gevonden in verband met subregio's van lipidevlotten die bekend staan als "caveolae" (uit het Engels "caveolae "), die nogal invaginaties zijn van het membraan dat rijk is aan cholesterol en een eiwit dat ermee geassocieerd is, caveolin genaamd.
Types
In de natuur zijn er drie goed gedefinieerde klassen van adenylaatcyclase en twee die momenteel onderwerp van discussie zijn..
- Klasse I: ze zijn aanwezig in veel gramnegatieve bacteriën zoals E coli, bijvoorbeeld waar het cyclische AMP-product van de reactie functies heeft als een ligand voor transcriptiefactoren die verantwoordelijk zijn voor de regulatie van katabole operons.
- Klasse II: aangetroffen in sommige pathogenen van bacteriële geslachten zoals Bacil of Bordetella, waar ze dienen als extracellulaire toxines. Het zijn eiwitten die worden geactiveerd door gastheercalmoduline (afwezig in bacteriën).
- Klasse III: deze staan bekend als de "universele" klasse en zijn fylogenetisch verwant aan guanylaatcyclasen, die soortgelijke functies vervullen. Ze worden aangetroffen in zowel prokaryoten als eukaryoten, waar ze worden gereguleerd door verschillende routes.
Zoogdier adenylaat cyclasen
Bij zoogdieren zijn ten minste negen soorten van deze enzymen gekloond en beschreven, gecodeerd door negen onafhankelijke genen en behorend tot de klasse III adenylcyclase.
Ze delen complexe structuren en membraantopologieën, evenals dubbele katalytische domeinen die kenmerkend voor hen zijn..
Voor zoogdieren komt de nomenclatuur die wordt gebruikt om naar isovormen te verwijzen overeen met de letters AC (voor adenylaatcyclase) en een nummer van 1 tot 9 (AC1 - AC9). Er zijn ook twee varianten van het AC8-enzym gerapporteerd.
De isovormen die in deze dieren aanwezig zijn, zijn homoloog met betrekking tot de volgorde van de primaire structuur van hun katalytische plaatsen en de driedimensionale structuur. De opname van een van deze enzymen in elk 'type' houdt voornamelijk verband met de regulerende mechanismen die op elke isovorm werken..
Ze hebben expressiepatronen die vaak weefselspecifiek zijn. Alle isovormen zijn te vinden in de hersenen, hoewel sommige beperkt zijn tot specifieke delen van het centrale zenuwstelsel.
Kenmerken
De belangrijkste functie van de enzymen die tot de adenylaatcyclase-familie behoren, is om ATP om te zetten in cyclisch AMP en hiervoor katalyseren ze de vorming van een intramoleculaire 3'-5'-diesterbinding (reactie vergelijkbaar met die gekatalyseerd door DNA-polymerasen). Met de afgifte van een pyrofosfaatmolecuul.
Bij zoogdieren zijn de verschillende varianten die kunnen worden bereikt gerelateerd aan celproliferatie, ethanolafhankelijkheid, synaptische plasticiteit, medicijnafhankelijkheid, circadiaans ritme, reukstimulatie, leren en geheugen..
Sommige auteurs hebben gesuggereerd dat adenylaatcyclasen een aanvullende functie kunnen hebben als transportermoleculen of, wat hetzelfde is, kanaaleiwitten en ionische transporters..
Deze hypothesen zijn echter alleen getest op basis van de rangschikking of topologie van de transmembraansegmenten van deze enzymen, die enkele homologieën of structurele overeenkomsten (maar geen sequentie) delen met bepaalde ionentransportkanalen..
Zowel cyclisch AMP als PPi (pyrofosfaat), de producten van de reactie, hebben functies op cellulair niveau; maar hun belang hangt af van het organisme waar ze zich bevinden.
Regulatie
De grote structurele diversiteit van adenylcyclasen toont een grote gevoeligheid aan voor meerdere vormen van regulering, waardoor ze kunnen worden geïntegreerd in een grote verscheidenheid aan cellulaire signaalroutes..
De katalytische activiteit van sommige van deze enzymen is afhankelijk van alfa-ketozuren, terwijl andere veel complexere regulatiemechanismen hebben waarbij regulerende subeenheden betrokken zijn (door stimulatie of remming) die bijvoorbeeld afhankelijk zijn van calcium en andere algemeen oplosbare factoren, evenals van andere factoren. eiwitten.
Veel adenylaatcyclasen worden negatief gereguleerd door subeenheden van sommige G-eiwitten (remmen hun functie), terwijl andere meer activerende effecten uitoefenen.
Referenties
- Cooper, D. M. F. (2003). Regulatie en organisatie van adenylylcyclasen en cAMP. Biochemical Journal, 375, 517-529.
- Cooper, D., Mons, N., & Karpen, J. (1995). Adenylylcyclasen en de interactie tussen calcium- en cAMP-signalering. Natuur, 374, 421-424.
- Danchin, A. (1993). Fylogenie van Adenylyl Cyclases. Vooruitgang in Second Messenger en Phosphoprotein Research, 27, 109-135.
- Hanoune, J., en Defer, N. (2001). Regulatie en rol van adenylylcyclase-isovormen. Ann. Rev. Pharmacol. Toxicol., 41, 145-174.
- Linder, U., & Schultz, J. E. (2003). De klasse III adenylylcyclasen: multifunctionele signaleringsmodules. Cellulaire signalering, vijftien, 1081-1089.
- Tang, W., & Gilman, A. G. (1992). Adenylyl Cyclases. Cel, 70, 669-672.


Niemand heeft nog op dit artikel gereageerd.