
Structuren, eigenschappen en voorbeelden van vertakte alkanen
De vertakte alkanen het zijn verzadigde koolwaterstoffen waarvan de structuur niet uit een rechte keten bestaat. Rechte alkanen worden onderscheiden van hun vertakte isomeren door een letter toe te voegen n voorafgaand aan de naam. N-hexaan betekent dus dat de structuur bestaat uit zes koolstofatomen die in een keten zijn uitgelijnd.
De takken van een kale boomkruin (onderste afbeelding) kunnen worden vergeleken met die van vertakte alkanen; de dikte van zijn kettingen, of ze nu hoofd-, secundair of tertiair zijn, hebben allemaal dezelfde afmetingen. Waarom? Omdat eenvoudige C-C-bindingen in allemaal aanwezig zijn.

Bomen hebben de neiging om zich te vertakken als ze groeien; Alkanen ook. Houd een constante keten aan met bepaalde methyleeneenheden (-CHtwee-) impliceert een reeks energetische condities. Hoe meer energie de alkanen hebben, hoe groter de neiging tot vertakking.
Zowel lineaire als vertakte isomeren hebben dezelfde chemische eigenschappen, maar met kleine verschillen in hun kook-, smelt- en andere fysische eigenschappen. Een voorbeeld van een vertakte alkaan is 2-methylpropaan, de eenvoudigste van allemaal.
Artikel index
- 1 Chemische structuren
- 2 Chemische en fysische eigenschappen
- 2.1 Kook- en smeltpunten
- 2.2 Dichtheid
- 3 Nomenclatuur en voorbeelden
- 4 referenties
Chemische structuren
Vertakte en lineaire alkanen hebben dezelfde algemene chemische formule: C.nH.2n + 2. Dat wil zeggen, beide hebben voor een bepaald aantal koolstofatomen hetzelfde aantal waterstofatomen. Daarom zijn de twee soorten verbindingen isomeren: ze hebben dezelfde formule maar verschillende chemische structuren..
Wat wordt als eerste waargenomen in een lineaire ketting? Een eindig aantal methyleengroepen, -CHtwee-. Dus de ch3CHtweeCHtweeCHtweeCHtweeCHtweeCH3 is een alkaan met een rechte keten genaamd n-heptaan.
Let op de vijf opeenvolgende methyleengroepen. Er moet ook worden opgemerkt dat deze groepen alle kettingen vormen, en daarom dezelfde dikte hebben, maar met variabele lengtes. Wat valt er nog meer over hen te zeggen? Dat zijn 2º koolstofatomen, dat wil zeggen koolstofatomen die zijn gekoppeld aan twee andere.
Om het genoemde n-heptaan te laten vertakken, is het nodig om zijn koolstofatomen en waterstofatomen te herschikken. Hoe? De mechanismen kunnen erg complex zijn en omvatten de migratie van atomen en de vorming van positieve soorten die bekend staan als carbokationen (-C+.
Op papier is het echter voldoende om de structuur zo te rangschikken dat er 3e en 4e koolstofatomen zijn; met andere woorden, koolstofatomen gebonden aan drie of vier andere. Deze nieuwe ordening is stabieler dan de lange groeperingen van CH-groepentwee. Waarom? Omdat de 3e en 4e koolstofatomen energetisch stabieler zijn.
Chemische en fysische eigenschappen
Vertakte en lineaire alkanen met dezelfde atomen behouden dezelfde chemische eigenschappen. Hun bindingen blijven eenvoudig, C-H en C-C, en met weinig verschil in elektronegativiteiten, dus hun moleculen zijn apolair. Het hierboven genoemde verschil ligt in de 3e en 4e koolstofatoom (CHR3 en CR4.
Naarmate de keten zich echter vertakt in de isomeren, verandert de manier waarop de moleculen met elkaar interageren..
De manier om twee lineaire takken van een boom samen te voegen, is bijvoorbeeld niet hetzelfde als twee sterk vertakte takken op elkaar plaatsen. In de eerste situatie is er veel oppervlaktecontact, terwijl in de tweede situatie de 'openingen' tussen de takken overheersen. Sommige takken hebben meer interactie met andere dan met de hoofdtak.
Dit alles resulteert in vergelijkbare waarden, maar niet hetzelfde in veel van de fysieke eigenschappen.
Kook- en smeltpunten
De vloeibare en vaste fasen van alkanen zijn onderhevig aan intermoleculaire krachten onder specifieke omstandigheden van druk en temperatuur. Omdat de moleculen van de vertakte en lineaire alkanen niet op dezelfde manier met elkaar in wisselwerking staan, zullen hun vloeistoffen of vaste stoffen ook niet hetzelfde zijn..
Smelt- en kookpunten nemen toe met het aantal koolstofatomen. Voor lineaire alkanen zijn deze evenredig met n. Maar voor vertakte alkanen hangt de situatie af van hoe vertakt de hoofdketen is en wat de substituent of alkylgroepen zijn (R).
Als de lineaire kettingen worden beschouwd als rijen zigzaglijnen, passen ze perfect op elkaar; maar met de vertakte ketens werken de hoofdketens nauwelijks samen omdat de substituenten ze uit elkaar houden.
Als resultaat hebben vertakte alkanen een kleiner moleculair contactoppervlak en daarom neigen hun smelt- en kookpunten iets lager te zijn. Hoe meer de structuur vertakt, hoe lager deze waarden nog zullen zijn.
Bijvoorbeeld n-pentaan (CH3CHtweeCHtweeCHtweeCH3) heeft een Peb van 36,1 ºC, terwijl 2-methylbutaan (CH3CHtwee(CH3) CHtweeCH3) en 2,2-dimethylpropaan (C (CH34) van 27,8 en 9,5 ° C.
Dichtheid
Met dezelfde redenering zijn vertakte alkanen iets minder dicht, vanwege het feit dat ze een groter volume innemen, vanwege het afname van het oppervlaktecontact tussen de hoofdketens. Net als lineaire alkanen zijn ze niet mengbaar met water en drijven ze erboven; dat wil zeggen, ze zijn minder dicht.
Nomenclatuur en voorbeelden
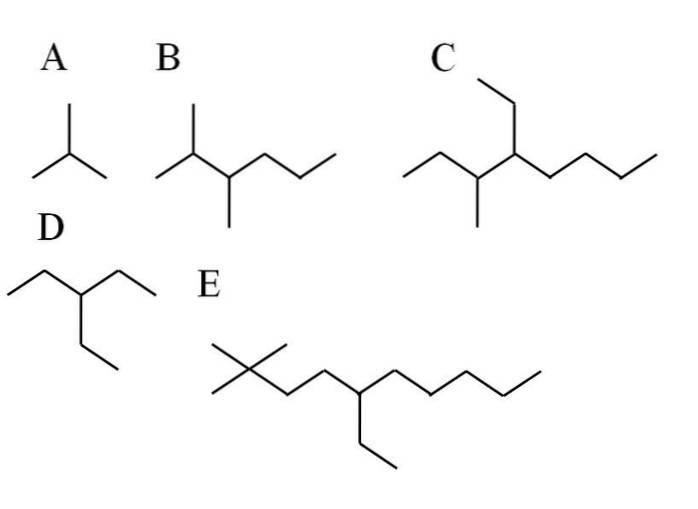
In de bovenstaande afbeelding worden vijf voorbeelden van vertakte alkanen getoond. Merk op dat de takken worden gekenmerkt door het hebben van 3e of 4e koolstofatomen. Maar wat is de hoofdketen? Degene met het hoogste aantal koolstofatomen.
-In A maakt het niet uit, want welke keten er ook wordt gekozen, ze hebben allebei 3 C. Dus hun naam is 2-methylpropaan. Het is een isomeer van butaan, C4H.10.
-Alkane B heeft op het eerste gezicht twee substituenten en een lange keten. To -CH groepen3 ze zijn zo genummerd dat ze het minste aantal hebben; daarom beginnen de koolstofatomen vanaf de linkerkant te tellen. B wordt dus 2,3-dimethylhexaan genoemd.
-Voor C geldt hetzelfde als voor B. De hoofdketen heeft 8 C en de twee substituenten een CH3 en een CHtweeCH3 ze zijn meer aan de linkerkant. De naam is daarom: 4-ethyl-3-methyloctaan. Merk op dat de -ethylsubstituent vóór de -methyl in alfabetische volgorde wordt vermeld.
-In het geval van D maakt het niet uit waar de koolstofatomen van de hoofdketen worden geteld. Zijn naam is: 3-ethylpropaan.
-En tot slot voor E, een iets complexer vertakt alkaan, heeft de hoofdketen 10 C en begint het te tellen vanaf een van de CH-groepen3 aan je linker kant. Op deze manier is de naam: 5-ethyl-2,2-dimethyl-decaan.
Referenties
- Carey, F. A. (2006). Organische chemie zesde editie. Redactioneel Mc Graw Hill, pagina's 74-81.
- John T. Moore, Chris Hren, Peter J. Mikulecky. Hoe vertakte alkanen in de chemie te benoemen. Hersteld van: dummies.com
- Dr. Ian Hunt. (2014). Eenvoudige vertakte alkanen. Genomen uit: chem.ucalgary.ca
- Helmenstine, Anne Marie, Ph.D. (8 januari 2018). Vertakte keten alkaan-definitie. Hersteld van: thoughtco.com
- Chemie LibreTexts. Alkanen met vertakte keten. Genomen uit: chem.libretexts.org
- Alkanen: structuur en eigenschappen. Genomen uit: uam.es
- Nomenclatuur: alkanen. [Pdf]. Genomen uit: quimica.udea.edu.co



Niemand heeft nog op dit artikel gereageerd.