
Benzoë structuur, eigenschappen, gebruik en risico's
De benzoë of benzoe Het is een witte kristallijne vaste stof met een kamfergeur die bestaat uit een organische verbinding. Het is een aceton, in het bijzonder een acetofenon met aangrenzende hydroxy- en fenylkoolstofatomen. Het wordt geproduceerd door katalytische condensatie van benzaldehyde, met kaliumcyanide als katalysator.
Het werd voor het eerst gerapporteerd in 1828 door Julius Von Liebig en Friedrich Woehler, tijdens hun onderzoek naar een bittere amandelolie, die bestond uit benzaldehyde en blauwzuur. De katalytische synthese van benzoë werd later verbeterd door Nikolai Zinin.
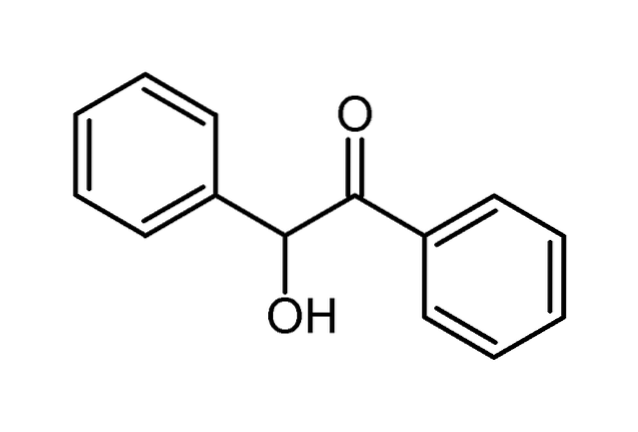
Benzoë is praktisch onoplosbaar in water, maar wel in hete alcohol en andere organische oplosmiddelen, zoals koolstofdisulfide en aceton..
Deze naam wordt ook gebruikt om te verwijzen naar benzoëhars, verkregen uit de boom Benzoë van Styrax. De hars bevat benzoëzuur, fenylpropionzuur, benzaldehyde, kaneelzuur, benzylbenzoaat en vanilline, waardoor het een vanillegeur krijgt..
Deze etherische olie moet niet worden verward met de samengestelde benzoë, die een andere samenstelling en oorsprong heeft..
Artikel index
- 1 Structuur van benzoë
- 2 Eigenschappen
- 2.1 Namen
- 2.2 Moleculaire formule
- 2.3 Molaire massa
- 2.4 Fysieke beschrijving
- 2.5 Smaak
- 2.6 Kookpunt
- 2.7 Smeltpunt
- 2.8 Vlampunt
- 2.9 Oplosbaarheid in water
- 2.10 Oplosbaarheid in organische oplosmiddelen
- 2,11 pH
- 2.12 Stabiliteit
- 2.13 Nog een experimentele eigenschap
- 3 Synthese
- 4 toepassingen
- 4.1 Tussenpersoon
- 4.2 In voedsel
- 4.3 Humane en diergeneeskunde
- 4.4 Persoonlijke verzorging
- 4.5 Gebruik van essentiële olie van benzoë
- 5 Toxiciteit
- 6 referenties
Structuur van benzoë
In de bovenstaande afbeelding werd de moleculaire structuur van benzoë getoond met een bolletjes- en staafjesmodel. Te zien is dat het twee aromatische ringen heeft, gescheiden door twee zuurstofhoudende koolstofatomen; van links naar rechts, CHOH en CO. Merk ook op dat de ringen verschillende oriëntaties in de ruimte hebben..
Het hydrofobe deel overheerst in zijn structuur, terwijl zuurstofatomen in geringe mate bijdragen aan het dipoolmoment; omdat beide aromatische ringen elektronendichtheid naar zich toe trekken, waardoor de lading homogener wordt verspreid.
Het resultaat is dat het benzoëmolecuul niet te polair is; wat rechtvaardigt dat het slecht oplosbaar is in water.
Door te focussen op beide zuurstofatomen, zal men zien dat de OH-groep een intramoleculaire waterstofbinding zou kunnen vormen met de aangrenzende carbonylgroep; dat wil zeggen, ze zouden niet twee benzoïne-moleculen binden, maar eerder zou een specifieke ruimtelijke conformatie worden versterkt, waardoor wordt voorkomen dat de H (OH) C-CO-binding te veel roteert.
Hoewel benzoïne niet als een molecuul met hoge polariteit wordt beschouwd, geeft zijn molecuulmassa het voldoende cohesiekracht om een monoklien wit kristal te definiëren, dat smelt rond 138ºC; afhankelijk van het niveau van onzuiverheden kan het op een lagere of hogere temperatuur zijn.
Eigendommen
Namen
Enkele van de vele aanvullende namen zijn:
- 2-hydroxy-1,2-difenylethanon.
- benzoylfenylcarbanol.
- 2-hydroxy-2-fenylacetofenon.
- 2-hydroxy-1,2-difenylethaan-1-on.
Moleculaire formule
C14H.12OFtwee of C6H.5COCH (OH) C6H.5.
Molaire massa
212,248 g / mol.
Fysieke beschrijving
Benzoë is een witte tot gebroken witte kristallijne vaste stof met een kamfergeur. Als ze gebroken zijn, zijn verse oppervlakken melkachtig wit. Het kan ook verschijnen als een droog poeder of witte of gele kristallen.
Smaak
Niet beschreven. Enigszins bijtend.
Kookpunt
344 ºC.
Smeltpunt
137 ºC.
Ontstekingspunt
181 ºC.
Oplosbaarheid in water
Vrijwel onoplosbaar.
Oplosbaarheid in organische oplosmiddelen
Oplosbaar in hete alcohol en koolstofdisulfide.
pH
In alcoholische oplossing is het zuur, bepaald door lakmoespapier.
Stabiliteit
In stal. Het is een brandbare verbinding en onverenigbaar met sterke oxidatiemiddelen.
Een andere experimentele eigenschap
Verlaag de oplossing van Fehling.
Synthese
De onderste afbeelding toont de condensatiereactie van benzaldehyde waarbij benzoïne ontstaat. Deze reactie wordt bevorderd in aanwezigheid van kaliumcyanide in ethylalcoholoplossing..
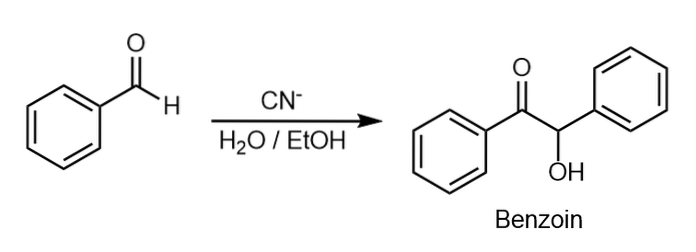
Twee benzaldehydemoleculen worden covalent met elkaar verbonden door een watermolecuul vrij te geven.
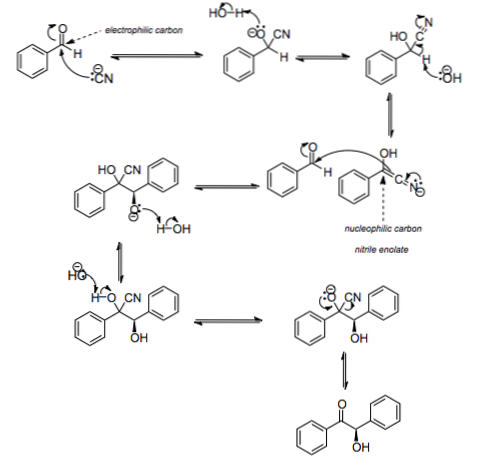
Hoe gebeurde dit? Via het hierboven afgebeelde mechanisme. CN anion- het werkt als een nucleofiel door de koolstof van de carbonylgroep van benzaldehyde aan te vallen. Door dit te doen, en met de deelname van water, wordt C = O C = N; maar nu wordt de H vervangen door een OH en wordt de benzaldehyde nitrilenolaat (tweede rij van de afbeelding).
De negatieve lading van stikstof wordt gedelokaliseerd tussen het en koolstof -C-CN; deze koolstof zou dan nucleofiel zijn (het zoekt naar positieve ladingen). Zo erg zelfs dat het de carbonylgroep van een ander benzaldehydemolecuul aanvalt.
Nogmaals, een watermolecuul komt tussenbeide om een OH te produceren- en deprotoneren van een OH-groep; die later een dubbele binding vormt met koolstof om een C = O-groep te doen ontstaan, terwijl de CN-groep migreert als een cyanide-anion. Dus de CN- katalyseert de reactie zonder te worden geconsumeerd.
Toepassingen
Tussenpersoon
Benzoë is betrokken bij de synthese van organische verbindingen door middel van katalytische polymerisatie. Het is een tussenproduct voor de synthese van α-benzoïne oxime, een analytisch reagens voor metalen. Het is een voorlopermiddel voor benzyl, dat als foto-initiator fungeert.
De synthese van benzyl vindt plaats door organische oxidatie met behulp van koper (III), salpeterzuur of ozon. Benzoë wordt gebruikt bij de bereiding van farmaceutische geneesmiddelen zoals oxaprozin, ditazol en fenytoïne.
In eten
Benzoë wordt gebruikt als smaakstof voor levensmiddelen.
Menselijke en diergeneeskunde
In de diergeneeskunde wordt het gebruikt als een antisepticum voor plaatselijke toepassing, gebruikt bij de behandeling van huidzweren om hun genezing te bewerkstelligen.
Het wordt ook in de geneeskunde gebruikt in formuleringen voor de bereiding van inhalatiemiddelen voor de behandeling van bronchitis en slijmoplossers voor oraal gebruik..
Persoonlijke verzorging
Benzoë wordt gebruikt bij de vervaardiging van deodorants.
Benzoë etherische olie gebruikt
Er is gemeld dat deze essentiële olie de bloedsomloop stimuleert. Er is ook melding gemaakt van een gunstige werking op het zenuwstelsel, die tot uiting komt in een verlichting van angst en stress. Evenzo is aangegeven dat het een antiseptische werking heeft op open wonden..
Sommige verbindingen die aanwezig zijn in etherische olie van benzoïne, zoals benzaldehyde, benzoëzuur en benzylbenzoaat, zijn bacteriedodende en fungicide stoffen die sepsis voorkomen..
Er is aangegeven dat het antiflatulente en windafdrijvende werking heeft, een effect dat wordt toegeschreven aan zijn ontspannende werking op de buikspieren. Evenzo wordt een diuretische werking toegeschreven die bijdraagt aan de eliminatie van giftige stoffen voor het lichaam.
Deze etherische olie wordt gebruikt als slijmoplossend middel dat luchtwegcongestie verlicht. Evenzo zijn ze gebruikt bij de verlichting van artritis, door middel van plaatselijke toepassing die de opname van medicinale componenten door de huid mogelijk maakt..
Toxiciteit
Benzoë veroorzaakt bij contact roodheid en irritatie van de huid en ogen. Bij inademing van het samengestelde stof treedt irritatie van de luchtwegen op, wat zich uit in hoesten. Over het algemeen is het echter geen erg giftige verbinding..
Aan de tinctuur van benzoë, een alcoholisch extract van de hars van de boom Stirax benzoë, Er is hem op een reeks giftige acties gewezen. Misschien omdat de tinctuur een mengsel is van verbindingen; inclusief benzoëzuur, benzaldehyde, etc..
Contact met de huid veroorzaakt geen noemenswaardige irritatie. Maar contact met de ogen kan irritatie veroorzaken, wat zich uit in roodheid, pijn, tranen en wazig zien..
Het inademen van de dampen van benzoëtinctuur kan irritatie van de luchtwegen, hoesten, niezen, loopneus, heesheid en keelpijn veroorzaken..
Ten slotte kan inname van de tinctuur gastro-intestinale irritatie veroorzaken, die zich manifesteert door buikpijn, misselijkheid, braken en diarree..
Referenties
- Wikipedia. (2019). Benzoë (organische verbinding). Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2019). Benzoë. PubChem-database. CID = 8400. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Donald L. Robertson. (2012). Meerstaps synthese co-enzym gekatalyseerde synthese van benzoë en derivaten. Hersteld van: home.miracosta.edu
- Tim Soderberg. (2014, 29 augustus). Vitamine B1. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- Haisa, S. Kashino en M. Morimoto. (1980). De structuur van benzoë. Acta Cryst. B36, 2832-2834. doi.org/10.1107/S0567740880010217
- Meenakshi Nagdeve. (21 mei 2019). 11 geweldige voordelen van essentiële olie van benzoë. Organische feiten. Hersteld van: organicfacts.net
- Bre. (2019). Benzoë etherische olie geliefd bij Ancient Royalty. Hersteld van: monq.com


Niemand heeft nog op dit artikel gereageerd.