
Beryllium geschiedenis, structuur, eigenschappen, gebruik
De beryllium Het is een metalen element dat behoort tot groep 2 of IIA van het periodiek systeem. Het is het lichtste aardalkalimetaal van de groep en wordt weergegeven door het symbool Be. Zijn atoom en kation zijn ook kleiner dan die van zijn soortgenoten (Mg, Ca, Sr ...).
Vanwege de ongebruikelijke ladingsdichtheid komt dit metaal meestal niet geïsoleerd voor. Van ongeveer 30 mineralen is bekend dat ze het bevatten, waaronder: beryl (3BeOAltweeOF36SiOtwee2HtweeO), bertrandiet (4BeO.2SiOtwee.2HtweeO), chrysoberyl (BeAltweeOF4), en de fenaquita (BetweeJa4.

Emerald, een edelsteen, is een variant van beryl. Pure beryllium is echter niet zo opvallend; het heeft bleke grijsachtige glinstering (bovenste afbeelding), en is bereikt in de vorm van zaden of zuigtabletten.
Beryllium heeft een reeks karakteristieke fysische eigenschappen. Het heeft een lage dichtheid; hoge thermische en elektrische geleidingen, evenals de thermische capaciteit en warmteafvoer; het is geen magnetisch metaal; en heeft ook een geschikte combinatie van stijfheid en elasticiteit.
Al deze eigenschappen hebben ertoe geleid dat beryllium een metaal is met vele toepassingen, variërend van het gebruik in legeringen met koper voor de vervaardiging van gereedschappen tot het gebruik in raketten, vliegtuigen, auto's, kernreactoren, röntgenapparatuur, resonantie nucleair magnetisch, enz.
Beryllium heeft 10 bekende isotopen, variërend van 5Wees een 14Wees, zijnde de 9Wees de enige stabiele. Evenzo is het een zeer giftig metaal, dat vooral de luchtwegen aantast, dus er is een beperking in het gebruik ervan..
Artikel index
- 1 Geschiedenis van zijn ontdekking
- 2 Structuur van beryllium
- 3 Elektronische configuratie
- 4 Eigenschappen
- 4.1 Fysieke beschrijving
- 4.2 Smeltpunt
- 4.3 Kookpunt
- 4.4 Dichtheid
- 4.5 Atoomradius
- 4.6 Covalente straal
- 4.7 Atoomvolume
- 4.8 Specifieke warmte
- 4.9 Versmeltingswarmte
- 4.10 Verdampingswarmte
- 4.11 Elektronegativiteit
- 4.12 Standaardpotentieel
- 4.13 Geluidssnelheid
- 4.14 Thermische uitzetting
- 4.15 Thermische geleidbaarheid
- 4.16 Chemische eigenschappen
- 5 Toepassingen
- 5.1 Ontwikkeling van tools
- 5.2 Spiegels maken
- 5.3 Bij ioniserende straling
- 5.4 In magnetisme genererende apparatuur
- 5.5 Kernreactoren
- 5.6 Metalen beschermer
- 6 Waar is?
- 7 Risico's
- 8 referenties
Geschiedenis van zijn ontdekking
Beryllium werd ontdekt door Louis-Nicolas Vauguelin in 1798 als een compositorisch element van het mineraal beryl en een silicaat van aluminium en beryllium.
Later slaagde de Duitse chemicus Frederic Wöhler er in 1828 in om beryllium te isoleren door kalium te laten reageren met berylliumchloride in een platinakroes..
Tegelijkertijd en onafhankelijk bereikte ook de Franse chemicus Antoine Bussy de isolatie van beryllium. Wöhler was de eerste die de naam beryllium voor het metaal suggereerde.
Het kreeg zijn huidige naam in 1957, omdat het voorheen bekend stond als glucinium, vanwege de zoete smaak van sommige van zijn zouten. Maar om verwarring met andere zoet smakende verbindingen te voorkomen, en met een plant genaamd glucine, werd besloten de naam te veranderen in beryllium..
Structuur van beryllium
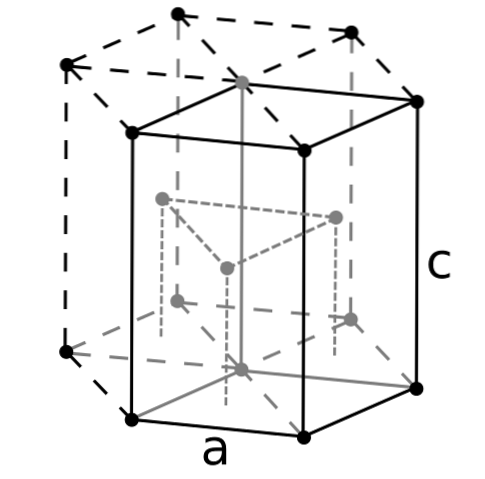
Omdat beryllium het lichtste van de aardalkalimetalen is, moet worden verwacht dat het volume van zijn atomen het kleinst is. Berylliumatomen interageren met elkaar via de metaalbinding, op zo'n manier dat hun "zee van elektronen" en de afstotingen tussen de kernen de structuur van het resulterende kristal bepalen..
De zwarte kristallen van beryllium worden dan gevormd. Deze kristallen hebben een hexagonale structuur (bovenste afbeelding), waarbij elk Be-atoom zes zijburen heeft en nog eens drie in de vlakken erboven en eronder..
Omdat de kristallen zwart zijn, is het handig om je voor te stellen dat de zwarte punten van de hexagonale structuur zijn vervangen door berylliumatomen. Dit is een van de meest compacte constructies die een metaal kan aannemen; en het is logisch dat de zeer kleine atomen van Be zo veel worden 'geperst' om de minste hoeveelheid leegte of aantal gaten ertussen te vermijden.
Elektronische configuratie
1stwee2 sectwee
Dat is gelijk aan 4 elektronen, waarvan 2 valentie. Als een elektron wordt gepromoveerd tot de 2p-orbitaal, hebben we twee sp-hybride orbitalen. In berylliumverbindingen kunnen er dus lineaire geometrieën zijn, X-Be-X; bijvoorbeeld het geïsoleerde molecuul BeCltwee, Cl-Be-Cl.
Eigendommen
Fysieke beschrijving
Glanzende, broze, staalgrijze vaste stof.
Smeltpunt
1287 ºC.
Kookpunt
2471 ºC.
Dichtheid
- 1.848 g / cm3 op kamertemperatuur.
- 1,69 g / cm3 tot smeltpunt (vloeibare toestand).
Atomaire radio
112 uur.
Covalente straal
90 uur.
Atoomvolume
5 cm3/ mol.
Specifieke hitte
1.824 J / gmol bij 20 ºC.
Warmte van fusie
12,21 kJ / mol.
Verdampingswarmte
309 kJ / mol.
Elektronegativiteit
1.57 op de schaal van Pauling.
Standaard potentieel
1,70 V.
Snelheid van geluid
12.890 m / s.
Thermische uitzetting
11,3 µm / m K bij 25 ºC.
Warmtegeleiding
200 w / m K.
Chemische eigenschappen
Beryllium is bedekt met een laag berylliumoxide (BeO) die het in lucht bij kamertemperatuur beschermt. De oxidatie van beryllium vindt plaats bij temperaturen boven 1000 ºC, afkomstig als producten berylliumoxide en berylliumnitride.
Het is ook bestand tegen de werking van salpeterzuur 15 M. Maar het lost op in zoutzuur en basen, zoals natriumhydroxide..
Toepassingen
Gereedschap maken
Beryllium vormt legeringen met koper, nikkel en aluminium. In het bijzonder produceert de legering met koper gereedschappen met een grote hardheid en weerstand, die slechts 2% van het gewicht van de legering uitmaken..
Deze gereedschappen produceren geen vonken bij het slaan met ijzer, waardoor ze kunnen worden gebruikt in omgevingen met een hoog gehalte aan brandbare gassen..
Vanwege zijn lage dichtheid heeft het een laag gewicht, waardoor het, samen met zijn stijfheid, kan worden gebruikt in ruimtevliegtuigen, raketten, raketten en vliegtuigen. De legering met beryllium is gebruikt bij de vervaardiging van auto-onderdelen. Het is ook gebruikt bij de productie van veren.
Vanwege de grote hardheid die beryllium aan zijn legeringen verleent, zijn ze gebruikt in de remmen van militaire vliegtuigen.
Spiegel maken
Beryllium is gebruikt bij de productie van spiegels vanwege de vormvastheid en het vermogen om zeer gepolijst te worden. Deze spiegels worden gebruikt in satellieten en in vuurleidingssystemen. Bovendien worden ze gebruikt in ruimtetelescopen.
Bij ioniserende straling
Beryllium is een element met een lage dichtheid, dus het kan worden beschouwd als transparant voor röntgenstralen Deze eigenschap maakt het mogelijk om het te gebruiken bij de constructie van de vensters van de buizen die röntgenstralen produceren, voor industriële toepassingen en voor medische diagnoses..
Beryllium wordt ook gebruikt in de ramen van radioactieve emissiedetectoren..
In magnetisme genererende apparatuur
Een van de kenmerken van beryllium is dat het geen magnetisch element is. Hierdoor kan het worden gebruikt bij de constructie van artikelen van magnetische resonantie-apparatuur, waarin magnetische velden met hoge intensiteit worden gegenereerd, waardoor eventuele interferentie wordt geminimaliseerd.
Kernreactor
Vanwege zijn hoge smeltpunt heeft het toepassing gevonden in kernreactoren en keramiek. Beryllium wordt gebruikt als moderator van kernreacties en als producent van neutronen:
9Worden + 4Hij (α) => 12C + n (neutronen)
Geschat wordt dat voor een miljoen berylliumatomen die worden gebombardeerd met α-deeltjes, tot 30 miljoen neutronen worden geproduceerd. Juist deze nucleaire reactie maakte de ontdekking van het neutron mogelijk.
James Chadwick bombardeerde berylliumatomen met α (He) -deeltjes. De onderzoeker observeerde het vrijkomen van subatomaire deeltjes, zonder elektrische lading, wat leidde tot de ontdekking van neutronen.
Metalen beschermer
Door een hoeveelheid beryllium toe te voegen aan het oppervlak van metalen die kunnen worden geoxideerd, krijgen ze enige bescherming. Zo wordt de ontvlambaarheid van magnesium verminderd en wordt de glans van zilverlegeringen verlengd.
Waar bevindt het zich?
Beryl wordt gevonden in pegmatiet, geassocieerd met mica, veldspaat en kwarts. Door gebruik te maken van een flotatietechniek wordt een mengsel van beryl en veldspaat gescheiden. Vervolgens worden veldspaat en beryl geconcentreerd en onderworpen aan een behandeling met calciumhypochloriet..
Gevolgd door een behandeling met zwavelzuur en kaliumsulfonaat, door middel van een verdunning, wordt de flotatie van de beryl bereikt, waardoor deze wordt gescheiden van de veldspaat.
Beryl wordt behandeld met natriumfluorsilicaat en soda bij 770 ° C om natriumfluorobylaat, aluminiumoxide en siliciumdioxide te vormen. Berylliumhydroxide wordt vervolgens met natriumhydroxide uit de natriumfluoroberylaatoplossing geprecipiteerd.
Berylliumfluoride wordt gevormd door berylliumhydroxide te laten reageren met ammoniakwaterstoffluoride, waarbij ammoniumtetrafluroberylaat wordt geproduceerd. Dit wordt verwarmd om berylliumfluoride te vormen, dat heet wordt behandeld met magnesium om het beryllium te isoleren..
Risico's
Beryllium als fijnverdeeld metaal, in de vorm van oplossingen, droog poeder of rook, is zeer giftig en kan dermatitis veroorzaken. De grootste toxiciteit wordt echter veroorzaakt door inademing.
In eerste instantie kan beryllium een overgevoeligheid of allergie veroorzaken, die zich kan ontwikkelen tot berylliose of chronische berylliumziekte (CBD). Dit is een ernstige ziekte die wordt gekenmerkt door een afname van de longcapaciteit.
Acute ziekte is zeldzaam. Bij chronische ziekten worden granulomen door het hele lichaam gevormd, vooral in de longen. Chronische berylliose veroorzaakt progressieve kortademigheid, hoest en algemene zwakte (asthenie).
Acute berylliose kan dodelijk zijn. Bij berylliose treedt het progressieve verlies van de ademhalingsfunctie op, omdat er een obstructie is in de stroom van gassen in de luchtwegen en een verminderde oxygenatie van het arteriële bloed..
Referenties
- Royal Society of Chemistry. (2019). Beryllium. Hersteld van: rsc.org
- Nationaal centrum voor informatie over biotechnologie. (2019). Beryllium. PubChem-database. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Helmenstine, Anne Marie, Ph.D. (15 maart 2019). Beryllium Feiten. Hersteld van: thoughtco.com
- Wikipedia. (2019). Beryllium. Hersteld van: en.wikipedia.org
- Lenntech B. V. (2019). Beryllium-Be. Hersteld van: lenntech.com
- Materio Corporation. (2019). Lees meer over het element beryllium Hersteld van: beryllium.com
- D. Michaud. (2016, 12 april). Berylliumverwerking en extractieprobleem. 911 Metallurg. Hersteld van: 911metallurgist.com
- Timothy P. Hanusa. (5 januari 2016). Beryllium. Encyclopædia Britannica. Hersteld van: britannica.com
- Lee S. Newman. (2014). Beryllium-ziekte. MSD-handleiding. Hersteld van: msdmanuals.com

Niemand heeft nog op dit artikel gereageerd.