
Borax geschiedenis, structuur, eigenschappen, gebruik, synthese, risico's
De borax of natriumboraat is een aanduiding voor een groep chemische verbindingen met een basisformule van NatweeB4OF7. Het is een hygroscopisch zout dat talrijke hydraten kan vormen en bovendien structureel verrijkt is door de aanwezigheid van bepaalde metaalonzuiverheden.
De belangrijkste verbindingen die de naam borax krijgen, zijn de volgende: watervrij natriumtetraboraat, NatweeB4OF7natriumtetraboraat pentahydraat (NatweeB4OF7) .5HtweeOF; en natriumtetraboraatdecahydraat, NatweeB4OF7.10HtweeOf, of het equivalent daarvan, natriumtetraboraatoctahydraat, NatweeB4OF5(OH)4.8HtweeOF.

Zoals duidelijk zal zijn, verschillen alle bovengenoemde vaste stoffen alleen in hun mate van hydratatie; sommige hebben meer watermoleculen in hun kristallen dan andere. Fysiek ziet borax eruit als stevige stukken of krijtkristallen (bovenste afbeelding).
Borax komt van nature voor in seizoensgebonden sedimenten in het meer, gedroogd door verdamping. Borax wordt geproduceerd in Turkije, Searles Lakes (Californië), in de Atacama-woestijn, Chili, Bolivia, Tibet en Roemenië. Boraxkristallen kunnen synthetisch worden verkregen door een langzaam kiemvormingsproces; dat wil zeggen, een waarin de groei van kristallen wordt bevorderd.
Natriumtetraboraat, watervrij en decahydraat, is slecht oplosbaar in koud water; maar de oplosbaarheid neemt toe met een stijging van de temperatuur. Dan eentweeB4OF7.10HtweeOf het is zeer oplosbaar in ethyleenglycol, matig oplosbaar in ethanol en enigszins oplosbaar in aceton; dit zijn minder polaire oplosmiddelen dan water.
Borax kent tal van toepassingen, zoals bij de vervaardiging van wasmiddelen en zepen; als brandvertrager voor cellulosemateriaal; bij de productie van glasvezel; bij het reinigen van harde oppervlakken zoals metalen, glas en keramiek; en onder andere bij het remmen van corrosie.
Borax is irriterend voor de ogen, de huid en de luchtwegen. Door inslikken kan het onder andere symptomen veroorzaken: braken, diarree, slapheid, bederf en toevallen. Momenteel wordt vermoed dat het schadelijke effecten kan hebben op de menselijke voortplanting.
Artikel index
- 1 Geschiedenis
- 2 Structuur van borax
- 3 kristallen
- 3.1 Verwarring met het boraatanion
- 4 Eigenschappen
- 4.1 Namen
- 4.2 Molecuulmassa
- 4.3 Fysiek voorkomen
- 4.4 Dichtheid
- 4.5 Smeltpunt
- 4.6 Kookpunt
- 4.7 Oplosbaarheid in water
- 4.8 Oplosbaarheid in organische oplosmiddelen
- 4.9 Brekingsindex (ηD)
- 4.10 Stabiliteit
- 4.11 Lichtemissie
- 4.12 Reacties
- 5 toepassingen
- 5.1 Antioxiderende werking
- 5.2 Vervaardiging van kleefstoffen
- 5.3 Brandvertragend
- 5.4 Vervaardiging van borosilicaatglas (Pyrex)
- 5.5 Emulgator
- 5.6 Reinigingsmateriaal
- 5.7 Medisch gebruik
- 5,8 pH-buffer
- 5.9 Verlaging van de waterhardheid
- 5.10 Meststof en compost
- 5.11 Houtverduurzaming
- 5.12 Flux en flux
- 5.13 Overige
- 6 Synthese
- 7 Risico's
- 8 referenties
Verhaal
De geschiedenis van borax is verwarrend. Er wordt gezegd dat het werd ontdekt in de bodem van een meer in Tibet, opgedroogd door verdamping. Het werd in de 8e eeuw overgebracht van Tibet naar Saoedi-Arabië, via de zogenaamde zijderoute.
De term 'borax' werd populair als gevolg van de talrijke toepassingen die werden gevonden en op de markt werden gebracht onder de naam 20 Mule Team Borax Tradermax, die verwees naar de manier waarop borax door de woestijnen van Nevada en Californië werd vervoerd..
Een andere versie van zijn ontdekking geeft aan dat de Egyptenaren al heel lang van het bestaan ervan wisten en het gebruikten bij het lassen van metalen door hitte. Bovendien gebruikten ze het in de geneeskunde en bij het mummificatieproces. Borax werd in de 13e eeuw door Marco Polo naar Europa overgebracht.
Halverwege de 19e eeuw werden grote afzettingen van borax ontdekt in de Mogave-woestijn, die sindsdien algemeen wordt gebruikt..
Structuur van borax

De bovenste afbeelding toont de ionen waaruit borax bestaat, specifiek overeenkomend met een vaste stof met een samenstellingsformule van Natwee[B4OF5(OH)4] · 8HtweeO (of NatweeB4OF710HtweeOF).
Ten eerste, de gekooide structuur van het anion [B4OF5(OH)4twee- (hoewel het twee gedeprotoneerde -OH-groepen zou moeten hebben, -O-), waarin een achthoekige ring (vier B- en vier O-atomen) te zien is, met een B-O-B-brug die deze in twee helften verdeelt.
Deze kooi blijft niet statisch, maar trilt en neemt verschillende vormen aan in de ruimte; echter in mindere mate in de buurt van de brug. Ook kan worden opgemerkt dat het erg "zuurstofrijk" is; dat wil zeggen, het heeft veel zuurstofatomen die via waterstofbruggen in wisselwerking kunnen treden met watermoleculen.
Het is dan ook niet verwonderlijk dat boraxkristallen kunnen hydrateren en talrijke hydraten kunnen genereren. Dus voor de vaste Natwee[B4OF5(OH)4] · 8HtweeOf er zijn acht moleculen van H.tweeOf interactie met de boraatkooi, en tegelijkertijd met de metalen centra van Na+.
Aan de kationzijde hebben we het waterige complex [Na (HtweeOF)4+n, waarbij de waarde van n afhangt van de anion / kation-verhouding. In de bovenste vaste stof, n = 2, hebben we dus: [Natwee(H.tweeOF)8twee+, waarvan de 2+ lading de 2-lading van het boraatanion neutraliseert.
Kristallen
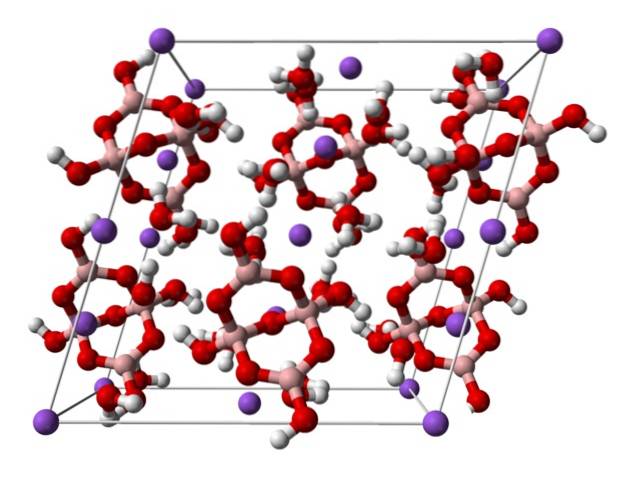
domein].
Hierboven is de monokliene eenheidscel voor Na-kristallentwee[B4OF5(OH)4] · 8HtweeO of NatweeB4OF710HtweeO. Hier regeren of domineren elektrostatische aantrekkingen en waterstofbruggen de structurele patronen die ontstaan in elke overspanning van het kristal..
De andere hydraten en het watervrije zout verliezen een of al hun watermoleculen, waardoor de samenstelling en structuur van het boraxkristal verandert. In alle gevallen blijven het anion en het kation hetzelfde (tenzij er onzuiverheden of nevenreacties zijn), dus er kan in dit opzicht geen verwarring bestaan..
Verwarring met het boraatanion
Natwee[B4OF5(OH)4] · 8HtweeO en NatweeB4OF710HtweeOf ze zijn hetzelfde. Waarom?
In de eerste plaats, als u de atomen telt, zult u zien dat ze in aantal samenvallen; en ten tweede in het anion B4OF7twee- er wordt rekening gehouden met de afwezigheid van de twee OH-groepen die zijn verbonden met de boorkoppen van de B-O-B-bruggen; twee OH die, samen met de twee H+ afkomstig van B4OF7twee-, voeg 2 H toetweeOf, wat een totaal van 10 H opleverttweeOf (8 + 2).
Eigendommen
Namen
- Borax.
- Natriumboraat.
- Natriumtetraboraat.
- Dinatriumtetraboraat.
Moleculaire massa
Watervrij: 201,22 g / mol.
Decahydraat: 381,38 g / mol.
Fysiek uiterlijk
Een witte kristallijne vaste stof.
Dichtheid
Watervrij: 2,4 g / cm3
Decahydraat: 1.739 g / cm3
Smeltpunt
Watervrij: 743 ° C (1.369 ° F, 1.016 K).
Decahydraat: 75 ºC.
Kookpunt
Watervrij: 1.575 ° C (2.867 ° F, 1.848 K).
Oplosbaarheid in water
31,78 g / L (voor zowel watervrij als decahydraat).
Oplosbaarheid in organische oplosmiddelen
Het is zeer oplosbaar in ethyleenglycol, matig oplosbaar in diethyleenglycol en methanol, en enigszins oplosbaar in aceton..
Brekingsindex (ηD)
Watervrij: η1 = 1447; ηtwee = 1.469.
Decahydraat: ηtwee = 1.472.
Stabiliteit
Het is stabiel onder de juiste opslagomstandigheden. Hoewel het een lage dampspanning heeft, neemt het toe met de temperatuur, wat leidt tot kristallisatie en condensatie, dus buitensporige schommelingen in temperatuur en vochtigheid moeten worden vermeden..
Lichtemissie
Natriumtetraboraat geeft bij blootstelling aan vuur een groen licht af.
Reacties
- Wanneer het in water oplost, produceert het alkalische oplossingen met een pH van ongeveer 9,2.
- Borax reageert om andere boraten te vormen, zoals perboraat (PBS).
- Het produceert ook boorzuur door te reageren met zoutzuur:
NatweeB4OF710HtweeO + HCl => 4 H3BO3 + 2 Na+ + 2 Cl- + 5 uurtweeOF
- Natriumtetraboraat gedraagt zich als een amfotere stof, omdat het in waterige oplossing hydrolyseert en zuren kan neutraliseren. Op dezelfde manier is het in staat om alkalische stoffen met een hoge concentratie te neutraliseren, waardoor een overmatige stijging van de pH van het medium wordt vermeden..
Toepassingen
Borax kent tal van toepassingen, zowel bij mensen als bij alle activiteiten die ze uitvoeren..
Antioxiderende werking
Borax heeft het vermogen om oxiden op te lossen. Om deze reden wordt het gebruikt bij het terugwinnen van metalen zoals messing, koper, lood en zink..
Het wordt ook gebruikt om de oxidatie van metalen staven in gieterijen te voorkomen. Borax bedekt het oppervlak, exclusief lucht, en voorkomt daarom oxidatie. Bovendien voorkomt het de corrosie van ijzerhoudend materiaal bij de automobielproductie.
De oplosbaarheid van borax in ethyleenglycol is nuttig geweest in antivriesformuleringen. Borax neutraliseert de zure residuen die worden geproduceerd tijdens de afbraak van ethyleenglycol, waardoor de oxidatie die het oppervlak van metalen kan ondergaan, wordt geminimaliseerd.
Vervaardiging van kleefstoffen
- Borax maakt deel uit van een zetmeelkleefstofformule voor golfpapier en karton.
- Het is een peptiserend middel bij de vervaardiging van kleefstoffen op basis van caseïne en dextrine.
- Het werkt door klevende materialen te versterken door de crosslinking van geconjugeerde hydroxylgroepen.
Brandvertragend
Het wordt gebruikt als brandvertrager in cellulosematerialen en andere polymeren die hydroxylgroepen bevatten. Het oefent zijn werking uit via verschillende mechanismen, waaronder de vorming van een glasachtige laag die de toegang van brandstoffen beperkt.
Vervaardiging van borosilicaatglas (Pyrex)
Borax is een bron van boor dat wordt gebruikt bij de vervaardiging van boorsilicaatglas; gekenmerkt door een hoog smeltpunt, lage uitzettingscoëfficiënt en hoge weerstand tegen thermische schokken.
Hierdoor kan het worden blootgesteld aan hoge temperaturen zonder breuken te ervaren, en krijgt het de naam vuurvast glas..
Borosilicaatglas wordt gebruikt bij de vervaardiging van materialen die in huis worden gebruikt om voedsel te bakken. Het wordt ook gebruikt in laboratoria in bekers, kolven, maatcilinders, pipetten, enz..
Emulgator
Borax wordt, samen met andere verbindingen, gebruikt om zepen en andere paraffines te emulgeren. Het wordt ook gebruikt als basis voor de productie van lotions, crèmes en zalven..
Schoonmaakproducten
- Het wordt in formuleringen toegevoegd om stevige oppervlakken zoals metalen, glas en keramiek te reinigen.
- Het wordt gebruikt in handreinigers, poetsmiddelen en wasmiddelzepen voor gebruik in wasserijen en thuis. Bovendien vergemakkelijkt het de verwijdering van olieachtige afzettingen van fabrieksvloeren.
Medisch gebruik
- Het wordt gebruikt bij de behandeling van schimmelinfecties van de voeten.
- Het maakt deel uit van de formule van voedingsstoffen die boor leveren. Aangenomen wordt dat dit element betrokken is bij het metabolisme van calcium, fosfor en magnesium, en mogelijk nodig is voor de botstructuur.
- Het is betrokken bij de bepaling van geglycosyleerd hemoglobine (HbA1C), een test die dient om de ontwikkeling van diabetes op lange termijn bij een patiënt te bepalen, aangezien de halfwaardetijd van een erytrocyt 120 dagen is..
Deze informatie is nuttiger voor de arts dan individuele bloedglucosemetingen van de patiënt..
PH-buffer
Het wordt gebruikt in verschillende buffersystemen die in de biochemie worden gebruikt; waaronder Tris (hydroxymethyl) aminomethaan-boraat, gebruikt in polyacrylamide-elektroforese van DNA- en RNA-nucleïnezuren.
Verlaging van de waterhardheid
Borax kan zich combineren met de calcium- en magnesiumionen die in water aanwezig zijn, waardoor hun concentratie afneemt. Op deze manier wordt de hardheid van het water verminderd.
Meststof en compost
Borax wordt gebruikt als een bron van boor. Calcium en boor zijn betrokken bij de vorming van de plantencelwand. Bovendien is erop gewezen dat boor de bestuiving bevordert, en daarom intervenieert het bij de bemesting en proliferatie van planten.
Behoud van hout
Borax bestrijdt houtworm, een kever die hout verteert en vernietigt. Het wordt ook gebruikt bij het conserveren en onderhouden van houten boten.
Flux en flux
Het wordt gebruikt als vloeimiddel bij het lassen van staal en ijzer, waardoor het smeltpunt daalt en ijzeroxide wordt verwijderd; een ongewenste verontreiniging. Voor een soortgelijk doel neemt hij deel aan het solderen van goud en zilver.
Anderen
- Het wordt gebruikt als een mild pesticide; bijvoorbeeld om motten op wol te bestrijden.
- Sproeien wordt gebruikt voor de bestrijding van ongedierte dat aanwezig is in kasten, interne tanks, in de holtes van de muren en in het algemeen waar het gebruik van meer vervuilende pesticiden niet gewenst is..
- Het wordt in kernreactoren gebruikt om reacties te beheersen die in extreme gevallen een kettingreactie kunnen veroorzaken.
- In autoradiatoren wordt borax gebruikt om plaatsen te blokkeren waar waterlekkage is.
Synthese
Borax wordt verkregen door het mineraal ulexiet, samengesteld uit de elementen boor, natrium en calcium, te laten reageren met de formule NaCaB5OF9.8HtweeOf, met natriumcarbonaat en natriumkoolcarbonaat in waterig medium.
In feite wordt de synthese van natriumtetraboraat of borax weinig gebruikt; het grootste deel van de geproduceerde verbinding wordt verkregen door de extractie van de mineralen die het bevatten.
Het proces kan worden samengevat in een oplossing van het erts in water, gevolgd door een filtratie in klei en tenslotte een verdamping van de waterige oplossing..
Risico's
Borax is een natuurlijk product, maar het kan een reeks van schade aan de menselijke gezondheid veroorzaken. Contact met boraxpoeder kan bijvoorbeeld huidirritatie veroorzaken die tot dermatitis kan leiden..
Evenzo veroorzaakt borax irritatie van de ogen en de bovenste luchtwegen. Symptomen van inademing zijn onder meer hoesten en keelpijn.
Ondertussen vertoont de inname van borax de volgende symptomen: braken, misselijkheid, diarree, slapheid, hoofdpijn en toevallen. Bovendien kunnen het centrale zenuwstelsel en de nierfunctie worden aangetast..
Uit onderzoeken bij mannelijke ratten die met borax werden gevoed, werd testiculaire atrofie bij hen waargenomen. Terwijl studies uitgevoerd met zwangere vrouwelijke ratten aangaven dat borax de placenta zou kunnen passeren, wat een verandering in de ontwikkeling van de foetus veroorzaakt, wat zich manifesteert door een laag geboortegewicht.
Aangenomen wordt dat blootstelling aan borax de mannelijke voortplantingsfunctie bij mannen beïnvloedt, wat zich uit in een vermindering van het aantal zaadcellen.
Een fatale dosis van 10 tot 25 gram wordt geschat voor borax-inname bij volwassenen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Nationaal centrum voor informatie over biotechnologie. (2019). Argon. PubChem-database. CID = 23968. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Karolyn Burns, Seneca Joseph en Dr. Ryan Baumbach. (s.f.). Synthese en eigenschappen van boraxkristallen en intermetallische legeringen. Hersteld van: nationalmaglab.org
- Wikipedia. (2019). Borax. Hersteld van: en.wikipedia.org
- Rio Tinto. (2019). Borax decahydraat. 20 Mule Team Borax. Hersteld van: borax.com
- Fletcher Jenna. (14 januari 2019). Is borax veilig te gebruiken? Hersteld van: medicalnewstoday.com

Niemand heeft nog op dit artikel gereageerd.