
Calmodulinestructuur, functies en werkingsmechanisme
Calmodulin is een term die "calcium-gemoduleerd eiwit" gaat betekenen, en verwijst naar een klein intracellulair eiwit dat de eigenschap heeft zich te binden aan het calciumion (Ca ++) en veel van zijn intracellulaire acties te mediëren. De oorsprong van het woord komt van de combinatie van de Engelse woorden 'calcium', 'gemoduleerd' en 'eiwit' die, wanneer ze worden samengevoegd, afgeleid zijn van LIMOENcium MODULated proteIN.
Van de minerale elementen die deel gaan uitmaken van de samenstelling van dierlijke organismen, is calcium, gevolgd door fosfor, verreweg de meest voorkomende, aangezien bot wordt gevormd door de afzetting in zijn matrix van grote hoeveelheden minerale zouten die uit dit ion worden gevormd..

Natuurlijk zijn deze minerale zouten van calcium essentieel voor de constitutie en conformatie van het skeletsysteem van gewervelde dieren, maar het is de geïoniseerde vorm van calcium (Ca ++) in oplossing in lichaamsvloeistoffen die een relevant fysiologisch belang krijgt voor het leven van dieren, organismen.
Dit kation, met twee overtollige positieve elektrische ladingen in zijn structuur, kan als een stroomdrager werken door door het celmembraan te bewegen en het niveau van elektrisch potentieel in veel van de prikkelbare cellen van het lichaam, voornamelijk in de hartspier, te wijzigen..
Maar van grotere fysiologische relevantie is het feit dat veel cellulaire regulerende reacties die worden veroorzaakt door externe stimuli, zoals neurotransmitters, hormonen of andere fysische of biochemische factoren, een soort metabolische cascades zijn waaraan verschillende eiwitten achtereenvolgens deelnemen, waarvan sommige enzymen zijn die vereisen calcium voor activering of inactivering.
Er wordt dan gezegd dat in deze gevallen calcium fungeert als een tweede boodschapper in een metabolische cascade die bestemd is om een eindresultaat te hebben dat zou gaan lijken op de cellulaire respons die nodig is om te voldoen aan een behoefte die wordt gedetecteerd op een ander niveau dan dat van de cel zelf, en dat het van haar dat specifieke antwoord vereist.
Calcium kan direct inwerken op zijn biochemische doelwit om zijn activiteit te beïnvloeden, maar het vereist vaak de deelname van een eiwit waarmee het moet binden om zijn effect uit te oefenen op de te modificeren proteïne (n). Calmodulin is een van die mediatoreiwitten.
Artikel index
- 1 Structuur
- 2 Functies van calmoduline
- 3 Werkingsmechanisme
- 3.1 Calmoduline en samentrekking van gladde spieren
- 3.2 Aanpassing in reuksensoren
- 4 Calmodulin in planten
- 5 referenties
Structuur
Calmoduline, zeer alomtegenwoordig, aangezien het tot expressie wordt gebracht in bijna alle celtypen van eukaryote organismen, is een klein zuur eiwit met een molecuulgewicht van ongeveer 17 kDa, waarvan de structuur sterk geconserveerd is tussen soorten..
Het is een monomeer eiwit, dat wil zeggen dat het bestaat uit een enkele polypeptideketen, die aan de uiteinden de vorm aanneemt van bolvormige domeinen die zijn verbonden door een alfa-helix. Elk bolvormig domein heeft twee motieven die bekend staan als de EF-hand. EF hand-) die kenmerkend zijn voor calciumbindende eiwitten.
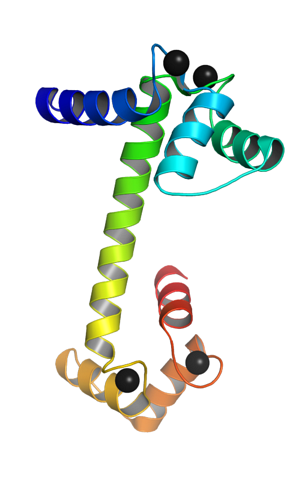
Deze topologische "EF-hand" -motieven vertegenwoordigen een soort van bovenliggende structuren; zijn met elkaar verbonden, in elk bolvormig domein, door een regio met grote flexibiliteit en in elk van hen is er een bindingsplaats voor Ca ++, wat in totaal 4 plaatsen oplevert voor elk calmodulinemolecuul.
De binding van positief geladen calciumionen wordt mogelijk gemaakt door de aanwezigheid van aminozuurresiduen met negatief geladen zijketens op de calciumbindende plaatsen van calmoduline. Deze residuen zijn drie aspartaten en één glutamaat..
Calmodulin-functies
Alle tot dusver bekende functies van calmoduline worden ingekaderd in een groep acties die wordt bevorderd door de toename van het cytosolische calcium dat wordt geproduceerd door het binnenkomen uit de extracellulaire ruimte of het verlaten van de intracellulaire afzettingen: mitochondriën en endoplasmatisch reticulum..
Veel van de acties van calcium worden uitgevoerd door dit ion door rechtstreeks in te werken op zijn doeleiwitten, die verschillende typen en functies kunnen hebben. Sommige van deze eiwitten kunnen niet direct worden beïnvloed, maar hebben calcium nodig om aan calmoduline te binden en het is dit complex dat inwerkt op het eiwit dat door het ion wordt beïnvloed..
Deze doeleiwitten zijn naar verluidt afhankelijk van calcium-calmoduline en omvatten tientallen enzymen, zoals eiwitkinasen, eiwitfosfatasen, nucleotide-cyclasen en fosfodiësterasen; allemaal betrokken bij een groot aantal fysiologische functies, waaronder:
- Metabolisme
- Deeltjes transport
- Viscerale mobiliteit
- De afscheiding van stoffen
- Bemesting van de eitjes
- Genexpressie
- Celproliferatie
- De structurele integriteit van cellen
- Intercellulaire communicatie, enz.
Onder de calmoduline-afhankelijke proteïnekinasen zijn: myosine lichte keten kinase (MLCK), fosforylasekinase en Ca ++ / calmodulinekinasen I, II en III.
De informatie die wordt gecodeerd door calciumsignalen (toename of afname van de intracellulaire concentratie) wordt dus "gedecodeerd" door deze en andere calciumbindende eiwitten, die de signalen omzetten in biochemische veranderingen; Met andere woorden, calmoduline is een intermediair eiwit in calciumafhankelijke signaalprocessen.
Werkingsmechanisme
Calmoduline is een zeer veelzijdig eiwit, aangezien de "doel" -eiwitten aanzienlijk verschillen in vorm, volgorde, grootte en functie. Omdat het een eiwit is dat fungeert als een ‘sensor’ voor calciumionen, hangt het werkingsmechanisme af van de veranderingen die in de structuur en / of conformatie worden geïnduceerd zodra het zich aan vier van deze ionen bindt..
Zijn werkingsmechanismen kunnen worden geïllustreerd door kort te kijken naar zijn deelname aan een aantal fysiologische processen, zoals samentrekking van viscerale gladde spieren en aanpassing aan geuren die worden ondervonden door de haarcellen van het reukslijmvlies in de neus..
Calmoduline en samentrekking van gladde spieren
Skelet- en hartspiercontractie wordt geactiveerd wanneer de toename van cytosolische Ca ++ niveaus boven 10-6 mol / l bereikt en dit ion bindt aan troponine C, dat allostere veranderingen ondergaat die tropomyosine beïnvloeden. Tropomyosine beweegt op zijn beurt en stelt zijn myosine-bindingsplaatsen in actine bloot, waardoor het contractiele proces wordt geactiveerd.
Troponine C komt niet voor in gladde spieren en de toename van Ca ++ boven het aangegeven niveau bevordert de binding met calmoduline. Het Ca-calmodulinecomplex activeert myosine lichte keten kinase (MLCK), die op zijn beurt deze lichte keten fosforyleert, myosine activeert en het contractiele proces in gang zet..
De toename van Ca ++ vindt plaats door het binnendringen van buitenaf of het verlaten van het sarcoplasmatisch reticulum door de werking van inositoltrifosfaat (IP3) dat wordt afgegeven door fosfolipase C in de cascade die wordt geactiveerd door receptoren die zijn gekoppeld aan Gq-eiwit. Ontspanning treedt op wanneer Ca ++, door de werking van transporteurs, uit het cytosol wordt verwijderd en terugkeert naar de oorspronkelijke locaties.
Een belangrijk verschil tussen beide soorten contractie is dat Ca ++ in dwarsgestreepte spieren (hart en skelet) allostere veranderingen induceert door binding met het eiwit troponine, terwijl in gladde spieren de veranderingen die door Ca-calmoduline worden geproduceerd covalent zijn en fosforylering van myosine inhouden..
Daarom is, zodra de werking van Ca ++ is beëindigd, de deelname van een ander enzym vereist om het fosfaat dat door het kinase wordt toegevoegd, te verwijderen. Dit nieuwe enzym is myosine lichte keten fosfatase (MLCP) waarvan de activiteit niet afhankelijk is van calmoduline, maar wordt gereguleerd door andere routes..
In werkelijkheid stopt het contractiele proces van gladde spieren niet volledig, maar de mate van contractie blijft op een gemiddeld niveau als gevolg van het evenwicht van de werking van beide enzymen, de MLCK gecontroleerd door Ca ++ en calmoduline, en de MLCP. onderworpen aan andere regelgevende controles.
Aanpassing in reuksensoren
De geur wordt geactiveerd wanneer reukreceptoren in de trilharen van cellen op het oppervlak van het reukslijmvlies worden geactiveerd..
Deze receptoren zijn gekoppeld aan een heterotrimeer G-eiwit dat bekend staat als "Golf" (olfactorisch G-eiwit), dat drie subeenheden heeft: "αolf", "ß" en "γ".
Wanneer reukreceptoren worden geactiveerd als reactie op een geur, dissociëren de subeenheden van dit eiwit en activeert de "αolf" -subeenheid het enzym adenylcyclase, waardoor cyclisch adenosinemonofosfaat (cAMP) wordt geproduceerd..
CAMP activeert CNG-achtige kanalen (geactiveerd door cyclische nucleotiden) voor calcium en natrium. Deze ionen komen de cel binnen, depolariseren deze en veroorzaken het initiëren van actiepotentialen waarvan de frequentie de intensiteit van de geur zal bepalen..
Het calcium dat binnenkomt, dat de neiging heeft de cel te depolariseren, heeft een antagonistisch effect van negatieve feedback, iets later, door zich te binden aan calmoduline en daartussen het kanaal te sluiten en de depolariserende stimulus te elimineren, ook al blijft de geurige stimulus aanhouden. Dit wordt sensoraanpassing genoemd.
Calmodulin in planten
Planten reageren ook op verschillen in de intracellulaire concentratie van calciumionen via het eiwit calmoduline. In deze organismen delen calmodulines veel structurele en functionele kenmerken met hun tegenhangers in dieren en gisten, hoewel ze verschillen in enkele functionele aspecten..
Calmoduline in planten bindt bijvoorbeeld aan korte peptidesequenties binnen hun doeleiwitten, waardoor structurele veranderingen worden geïnduceerd die hun activiteiten veranderen als reactie op interne variaties in calcium..
In hoeverre calmoduline processen controleert die analoog zijn aan die bij dieren in planten, is iets dat vandaag de dag nog steeds een punt van discussie is..
Referenties
- Brenner B: Musculatur, in: Fysiologie, 6e ed; R. Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: Cellular & Molecular Basis of Medical Physiology, in: Herziening van medische fysiologie, 25e ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Inleiding tot endocrinologie, in: Textbook of Medical Physiology, 13e editie, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorisches System, In: Physiologie, 4e druk; P Deetjen et al (eds). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle als Grundbaustein, in: Fysiologie, 6e ed; R. Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Zielinski, R. E. (1998). Calmoduline en calmoduline-bindende eiwitten in planten. Jaaroverzicht van plantenbiologie, 49 (1), 697-725.


Niemand heeft nog op dit artikel gereageerd.