
Aluminiumcarbonaatstructuur, eigenschappen, gebruik

De aluminium carbonaat is een anorganisch zout waarvan de chemische formule Al istwee(CO33. Het is een praktisch onbestaand metallisch carbonaat, gezien zijn hoge instabiliteit onder normale omstandigheden..
Een van de redenen voor zijn instabiliteit kunnen we de zwakke elektrostatische interacties tussen Al-ionen noemen3+ en co3twee-, die in theorie erg sterk zouden moeten zijn vanwege de omvang van hun ladingen.
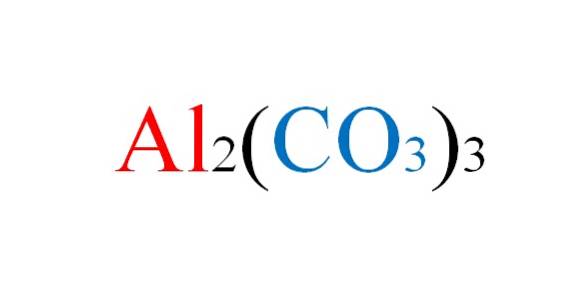
Zout ondervindt op papier geen ongemak wanneer de chemische vergelijkingen van zijn reacties worden geschreven; maar in de praktijk keert het zich tegen hem.
Ondanks wat er is gezegd, kan aluminiumcarbonaat in het gezelschap van andere ionen voorkomen, zoals bij het mineraal dawsoniet. Er is ook een derivaat waarin het in wisselwerking staat met waterige ammoniak. Voor de rest wordt het beschouwd als een mengsel tussen Al (OH)3 en HtweeCO3wat gelijk is aan een bruisende oplossing met een wit neerslag.
Dit mengsel heeft medicinale toepassingen. Echter, naar het zuivere, isoleerbare en manipuleerbare zout van Altwee(CO33, geen bekende mogelijke toepassingen; in ieder geval niet onder enorme druk of extreme omstandigheden.
Artikel index
- 1 Structuur van aluminiumcarbonaat
- 1.1 Aluminium ammoniumhydroxidecarbonaat
- 2 Eigenschappen
- 2.1 Molaire massa
- 2.2 Instabiliteit
- 2.3 Fysiek
- 3 toepassingen
- 4 referenties
Structuur van aluminiumcarbonaat
De kristalstructuur van dit zout is onbekend, omdat het zo onstabiel is dat het niet gekarakteriseerd kon worden. Van zijn formule Altwee(CO33, Het is echter bekend dat het aandeel van Al-ionen3+ en co3twee- is 2: 3; dat wil zeggen, voor elke twee Al kationentwee+ er moeten drie CO-anionen zijn3twee- elektrostatisch met hen in wisselwerking staan.
Het probleem is dat beide ionen erg ongelijk in grootte zijn; de Al3+ is erg klein terwijl CO3twee- het is omvangrijk. Dit verschil op zichzelf heeft al invloed op de roosterstabiliteit van het kristalrooster, waarvan de ionen "onhandig" zouden interageren als dit zout in vaste toestand zou kunnen worden geïsoleerd.
Naast dit aspect, de Al3+ het is een sterk polariserend kation, een eigenschap die de elektronische wolk van CO vervormt3twee-. Het is alsof je het wilt dwingen om covalent te binden, ook al kan het anion dat niet..
Bijgevolg ionische interacties tussen Al3+ en co3twee- ze neigen naar covalentie; een andere factor die bijdraagt aan de instabiliteit van Altwee(CO33.
Aluminium ammoniumhydroxidecarbonaat
De chaotische relatie tussen de Al3+ en co3twee- wordt zachter als er andere ionen in het glas aanwezig zijn; zoals NH4+ en OH-, uit een oplossing van ammoniak. Dit ionenkwartet, Al3+, CO3twee-, NH4+ en OH-, ze slagen erin om stabiele kristallen te definiëren, zelfs in staat om verschillende morfologieën aan te nemen.
Een ander vergelijkbaar voorbeeld wordt waargenomen in het mineraal dawsoniet en zijn orthorhombische kristallen, NaAlCO3(OH)twee, waar de Na+ vervangt NH4+. In deze zouten zijn hun ionische bindingen sterk genoeg dat het water de afgifte van CO niet bevordert.tweeof in ieder geval niet abrupt.
Hoewel de NH4Al (OH)tweeCO3 (AACC, voor de afkorting in het Engels), noch de NaAlCO3(OH)twee vertegenwoordigen aluminiumcarbonaat, kunnen ze worden beschouwd als basisderivaten daarvan.
Eigendommen
Molaire massa
233,98 g / mol.
Instabiliteit
In de vorige paragraaf werd vanuit moleculair perspectief uitgelegd waarom Altwee(CO33 het is onstabiel. Maar welke transformatie ondergaat het? Er zijn twee situaties waarmee u rekening moet houden: de ene droog en de andere 'nat'.
Droog
In de droge situatie is het anion CO3twee- keert terug naar COtwee door de volgende ontleding:
Naar detwee(CO33 => AltweeOF3 + 3COtwee
Dat is logisch als het onder hoge CO-druk wordt gesynthetiseerd.tweedat wil zeggen, de omgekeerde reactie:
Naar detweeOF3 + 3COtwee => Altwee(CO33
Daarom, om Al te voorkomentwee(CO33 het zout moet aan hoge druk worden blootgesteld (gebruik Ntwee, bijvoorbeeld). Op deze manier wordt CO gevormdtwee zou thermodynamisch niet worden begunstigd.
Nat
Terwijl in de natte situatie de CO3twee- ondergaat hydrolyse, waarbij kleine hoeveelheden OH worden gegenereerd-maar genoeg om het aluminiumhydroxide, Al (OH), neer te slaan3
CO3twee- + H.tweeOF <=> HCO3- + Oh-
Naar de3+ + 3OH- <=> Al (OH)3
En aan de andere kant, de Al3+ hydrolyseert ook:
Naar de3+ + H.tweeOF <=> Al (OH)tweetwee+ + H.+
Hoewel de Al eigenlijk eerst zou hydrateren3+ om het complexe Al (HtweeOF)63+, die wordt gehydrolyseerd om [Al (HtweeOF)5OH]twee+ en H3OF+. Dan is de H.3O (of H+) protonen tegen CO3twee- tot HtweeCO3, die ontleedt tot COtwee en HtweeOF:
CO3twee- + 2H+ => HtweeCO3
H.tweeCO3 <=> COtwee + H.tweeOF
Merk op dat uiteindelijk de Al3+ gedraagt zich als een zuur (geeft H+) en een basis (geeft OH vrij- met de oplosbaarheidsbalans van Al (OH)3dat wil zeggen, het vertoont amfoterie.
Fysiek
Als het kan worden geïsoleerd, is dit zout waarschijnlijk wit van kleur, net als veel andere aluminiumzouten. Ook vanwege het verschil tussen de ionstralen van Al3+ en co3twee-, het zou zeker een zeer laag smeltpunt of kookpunt hebben in vergelijking met andere ionische verbindingen.
En wat betreft zijn oplosbaarheid, het zou oneindig oplosbaar zijn in water. Bovendien zou het een hygroscopische en vervloeiende vaste stof zijn. Dit is echter slechts giswerk. Andere eigenschappen zouden moeten worden geschat met computermodellen die onder hoge druk staan..
Toepassingen
De bekende toepassingen van aluminiumcarbonaat zijn medisch. Het werd gebruikt als een mild samentrekkend middel en als medicijn om maagzweren en ontstekingen te behandelen. Het is ook gebruikt om de vorming van urinestenen bij mensen te voorkomen..
Het is gebruikt om een verhoging van het fosfaatgehalte in het lichaam onder controle te houden en ook om symptomen van brandend maagzuur, zure oprispingen en maagzweren te behandelen..
Referenties
- XueHui L., Zhe T., YongMing C., RuiYu Z. & Chenguang L. (2012). Hydrothermische synthese van ammoniumaluminiumcarbonaathydroxide (AACH) nanoplatelets en nanovezels pH-gecontroleerde morfologieën. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammoniumaluminiumcarbonaathydroxide NH4Al (OH) 2CO3 als alternatieve route voor de bereiding van aluminiumoxide: vergelijking met de klassieke boehmietvoorloper. Poedertechnologie, 320, 565-573, DOI: 10.1016 / j.powtec.2017.07.0080
- Nationaal centrum voor informatie over biotechnologie. (2019). Aluminium carbonaat. PubChem-database., CID = 10353966. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Aluminium carbonaat. Hersteld van: en.wikipedia.org
- Aluminiumsulfaat. (2019). Aluminium carbonaat. Hersteld van: aluminiumsulfate.net



Niemand heeft nog op dit artikel gereageerd.