
Carbon 12 nucleaire notatie, geschiedenis, opmerkingen
De koolstof-12 het is de meest voorkomende isotoop van het element koolstof, met 98,93% overvloed. Bovendien is het de belangrijkste verantwoordelijke voor alle eigenschappen en toepassingen die aan het element koolstof worden toegeschreven..
De 12C, met een atomaire massa van precies 12 dalton, dient als referentie voor het bepalen van de atomaire massa van de rest van de nucliden. Het atoom van 12C bestaat uit zes protonen, neutronen en elektronen; de massa van de elektronen wordt echter als verwaarloosbaar beschouwd.
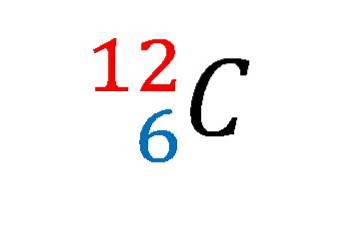
Elementen hebben meestal atoommassa's uitgedrukt als hele getallen, gevolgd door decimalen, omdat elementen verschillende stabiele isotopen kunnen hebben.
Daarom worden de atoommassa's van de elementen uitgedrukt als het gewogen gemiddelde van de atoommassa's van hun verschillende isotopen. Gezien het feit dat de 12C heeft een overvloed van 98,93%, en de 13C een overvloed van 1,15%, de atoommassa van koolstof is 12,011 dalton.
De atoommassa van een element wordt uitgedrukt als het gemiddelde van de atoommassa's van zijn verschillende atomen in verhouding tot een twaalfde van de massa van het element. 12C, bekend als een verenigde atomaire massa-eenheid; voorheen afgekort als "uma", en momenteel als "u".
Artikel index
- 1 Nucleaire notatie
- 2 Geschiedenis
- 3 Algemene opmerkingen
- 4 referenties
Nucleaire notatie
In de afbeelding hierboven werd de notatie of het nucleaire symbool voor de isotoop koolstof-12 getoond.
Het beschrijven ervan is hetzelfde als het vaststellen van de kenmerken van het koolstofatoom bij uitstek. Het atoomnummer 6 geeft het aantal protonen in zijn kern aan. Het getal 12 is gelijk aan de som van de protonen en neutronen, en is dus de atoommassa; die evenredig is met de nucleaire massa.
En hoewel deze notatie het niet laat zien, zijn er 6 elektronen die de positieve lading van de protonen in de kern tegenwerken. Vanuit het oogpunt van chemische bindingen zijn vier van deze zes elektronen degenen die de basis vormen van het leven zoals wij dat kennen..
Verhaal
Het onderzoek van Dalton (1810) gaf aan dat water een zuurstofpercentage van 87,7% en waterstof van 12,5% bevatte. Maar Dalton wees erop dat de formule voor het water OH was. Davy en Berzelius (1812) corrigeerden de formule voor water naar H.tweeOF.
Vervolgens vond Berzelius de volgende watersamenstelling: zuurstof 88,8% en waterstof 11,2%. Hij was van mening dat het atoomgewicht van waterstof 1 g is en dat van zuurstof 16 g.
Toen realiseerden ze zich dat als het atoomgewicht van 1 g voor waterstof werd gebruikt, het atoomgewicht van zuurstof 15,9 g zou zijn. Deze reden leidde onder meer tot de vaststelling van de atoommassa van zuurstof van 16 g als referentiestandaard voor de atoommassa's van de verschillende chemische elementen..
Zuurstof werd gebruikt als referentiestandaard vanaf het einde van de 19e eeuw tot 1961, toen werd besloten om koolstof te gebruiken als referentiestandaard voor het bepalen van de atoommassa's van de verschillende elementen..
Vóór 1959 gebruikten IUPAP en IUPAC het element zuurstof om de mol als volgt te definiëren: 1 mol is het aantal zuurstofatomen dat aanwezig is in 16 g.
Algemene opmerkingen
Praten over 12C verwijst naar koolstof als geheel; of ten minste 98% van de essentie, wat voldoende is voor een dergelijke benadering. Dit is de reden waarom deze isotoop op zichzelf geen nut heeft, terwijl het element als zodanig, en de vaste stoffen die het integreert, honderden toepassingen bestrijken..
Opgemerkt moet echter worden dat levende organismen een bijzondere voorkeur hebben voor deze isotoop dan voor 13C; dat wil zeggen, het percentage van 13C of de relatie 12C /13C varieert afhankelijk van ecosystemen, regio's of diersoorten.
Dit komt misschien doordat moleculen met te veel koolstofatomen 13C, zwaarder, stofwisselingsprocessen en de werking van de lichaamscellen belemmeren of verstoren; zelfs als het percentage van 13C in levende wezens was iets meer dan 1%.
Daarom, de 12C is de isotoop van koolstof die verantwoordelijk is voor leven. En de 14C de "tijdmeter" van zijn overblijfselen, dankzij zijn radioactief verval.
Een ander indirect nut van 12C is om "contrast" te creëren voor de nucleaire magnetische resonantiespectroscopietechniek van de 13C, waarmee de koolstofstructuur van organische verbindingen kan worden opgehelderd (ontdekt en geconstrueerd).
Referenties
- Phillips, Basil. (08 juli 2019). Wat is de meest voorkomende isotoop van koolstof? sciencing.com. Hersteld van: sciencing.com
- César Tomé López. (2019). Van de atoomgewichten. Hersteld van: culturacientifica.com
- ElSevier. (2019). Koolstof-12. ScienceDirect. Hersteld van: sciencedirect.com
- R. Schip. (s.f.). Nucleaire notatie. Hersteld van: hyperphysics.phy-astr.gsu.edu
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.


Niemand heeft nog op dit artikel gereageerd.