
Arseentrioxide (As2O3) structuur, eigenschappen en toepassingen
De arseentrioxide is een anorganische verbinding waarvan de chemische formule As istweeOF3. Arseen in zijn metallische toestand wordt snel omgezet in dit oxide, een zeer giftig gif dat acute en chronische manifestaties kan hebben..
Aangezien arseen en zuurstof elementen zijn van het p-blok, met een relatief laag elektronegativiteitsverschil, wordt verwacht dat AstweeOF3 is samengesteld uit een covalente aard; dat wil zeggen dat de As-O-bindingen de overhand hebben in zijn vaste stof, over de elektrostatische interacties tussen de As-ionen3+ metwee-.

Acute intoxicatie met arseentrioxide treedt op bij inslikken of inademen, waarvan de belangrijkste manifestaties zijn: ernstige gastro-intestinale stoornissen, krampen, circulatoire collaps en longoedeem..
Ondanks zijn giftigheid is het echter industrieel gebruikt; bijvoorbeeld bij de conservering van hout, bij de productie van pigmenten, halfgeleiders, enz. Evenzo werd het vroeger gebruikt bij de behandeling van talrijke ziekten.
Arseentrioxide is een amfotere verbinding, oplosbaar in verdunde zuren en logen, onoplosbaar in organische oplosmiddelen en relatief oplosbaar in water. Het komt voor als een vaste stof (bovenste afbeelding), met twee kristallijne vormen: kubisch en monoklien.
Artikel index
- 1 Structuur van arseentrioxide
- 1.1 Claudetite
- 1.2 Vloeibaar en gasvormig
- 1.3 Arsenoliet
- 2 Eigenschappen
- 2.1 Handelsnamen
- 2.2 Molecuulgewicht
- 2.3 Fysiek uiterlijk
- 2.4 Geur
- 2.5 Smaak
- 2.6 Kookpunt
- 2.7 Smeltpunt
- 2.8 Vlampunt
- 2.9 Oplosbaarheid in water
- 2.10 Oplosbaarheid
- 2.11 Dichtheid
- 2.12 Dampspanning
- 2.13 Ontleding
- 2.14 Corrosiviteit
- 2.15 Verdampingswarmte
- 2.16 Dissociatieconstante (Ka)
- 2.17 Brekingsindex
- 3 Reactiviteit
- 4 Nomenclatuur
- 5 toepassingen
- 5.1 Industrieel
- 5.2 Artsen
- 6 referenties
Structuur van arseentrioxide
Claudetita
Bij kamertemperatuur, AstweeOF3 kristalliseert in twee monokliene polymorfen, beide gevonden in het mineraal claudetiet. Ze hebben trigonale piramide-eenheden AsO3, die zijn verbonden door hun zuurstofatomen om het elektronische defect van de eenheid op zichzelf te compenseren.
In een polymorf de AsO-eenheden3 ze zijn met elkaar verbonden en vormen rijen (claudetite I), en in de andere zijn ze verbonden alsof ze een net weven (claudetite II):
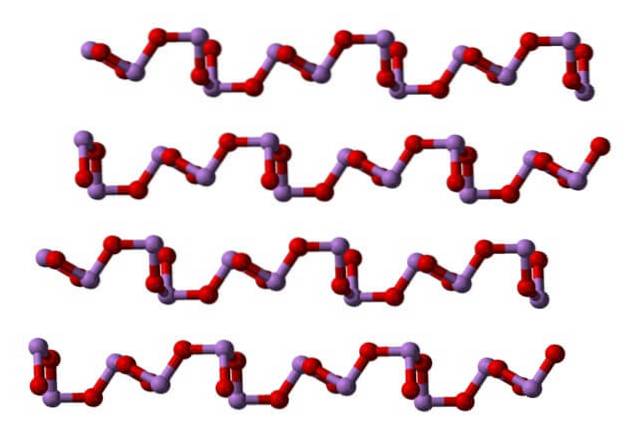
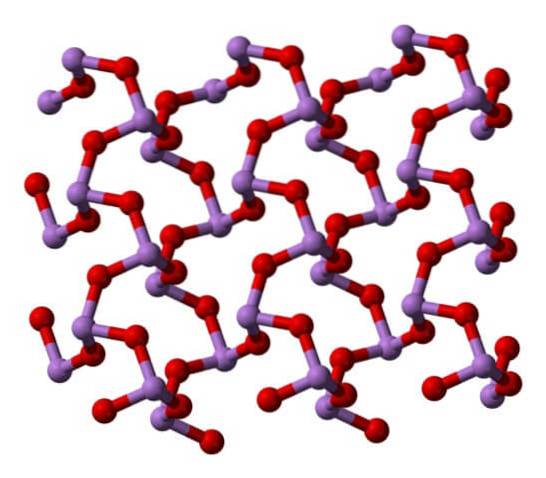
Vloeibaar en gasvormig
Wanneer al die structuren die monokliene kristallen definiëren, worden verwarmd, zijn de trillingen zodanig dat verschillende As-O-bindingen worden verbroken en een kleiner molecuul de overhand krijgt: As4OF6. De structuur is weergegeven in de onderstaande afbeelding.

Men zou kunnen zeggen dat het uit een dimeer van As bestaattweeOF3. De stabiliteit is zodanig dat het 800 ° C in de gasfase ondersteunt; maar boven deze temperatuur fragmenteert het in As-moleculentweeOF3.
Arsenoliet
Dezelfde aas4OF6 kunnen met elkaar in wisselwerking treden om te kristalliseren tot een kubieke vaste stof, waarvan de structuur wordt aangetroffen in het mineraal arsenoliet.
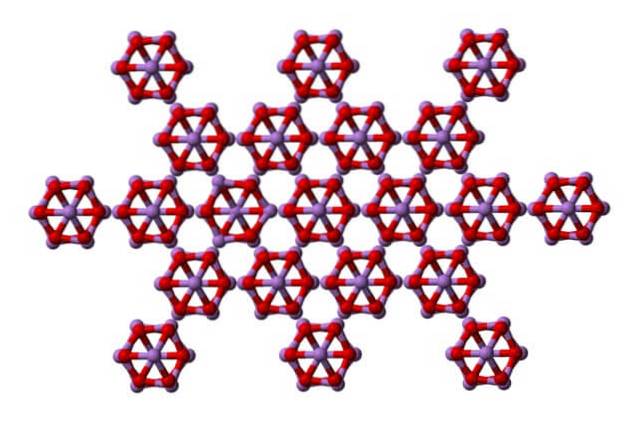
Merk op dat de afbeelding de structuur vanuit een hoger vlak laat zien. In vergelijking met claudetiet is het structurele verschil met arsenoliet duidelijk. Hier zijn het afzonderlijke moleculen van As4OF6 dat eenheden worden onderhouden door Van der Waals-strijdkrachten.
Eigendommen
Ruilnamen
-Arsenoliet
-Arsodent
-Trisenox
-Claudetita
Molecuulgewicht
197,84 g / mol.
Fysiek uiterlijk
-Witte kubieke kristallen (arsenoliet).
-Kleurloze monokliene kristallen (Claudetite).
-Witte of transparante vaste stof, glasachtige, amorfe klonten of kristallijn poeder.
Geur
Toilet.
Smaak
Smaakloos.
Kookpunt
460 ºC.
Smeltpunt
-313 ºC (Claudetite).
-274 ºC (arsenoliet).
ontstekingspunt
485 º C (sublimeert).
Oplosbaarheid in water
17 g / L bij 18 ºC (20 g / L bij 25 ºC).
Oplosbaarheid
Oplosbaar in zuren (vooral zoutzuur) en logen. Vrijwel onoplosbaar in chloroform en ether.
Dichtheid
-3,85 g / cm3 (kubieke kristallen);
-4,15 g / cm3 (ruitvormige kristallen).
Dampdruk
2,47 10-4 mmHg bij 25 ºC.
Ontleding
Het is niet brandbaar, maar bij verhitting kan het giftige rook veroorzaken, waaronder arsine..
Corrosiviteit
In aanwezigheid van vocht kan het bijtend zijn voor metalen.
Warmte van verdamping
77 kJ / mol.
Dissociatieconstante (Ka)
1.110-4 bij 25 ºC.
Brekingsindex
-1755 (arsenoliet)
-1.92-2.01 (Claudetiet).
Reactiviteit
-Arseentrioxide is een amfotere verbinding, maar functioneert bij voorkeur als een zuur.
-Kan reageren met zoutzuur of fluorwaterstofzuur, waarbij arseentrichloride of arseentrifluoride wordt gevormd.
-Evenzo reageert het met sterk oxiderende stoffen, zoals salpeterzuur, waardoor arseenzuur en lachgas ontstaat..
-Arseentrioxide kan reageren met salpeterzuur, waarbij arsine of het element arseen ontstaat, afhankelijk van de reactieomstandigheden..
AastweeOF3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn (GEEN3twee + 3 H.tweeOF.
Deze reactie diende als basis voor de oprichting van de Marsh-test, die werd gebruikt om arseenvergiftiging op te sporen..
Nomenclatuur
BijtweeOF3 Het kan worden genoemd volgens de volgende nomenclaturen, wetende dat arseen werkt met valentie +3:
-Arseenoxide (traditionele nomenclatuur).
-Arseen (III) oxide (voorraadnomenclatuur).
-Diarseentrioxide (systematische nomenclatuur).
Toepassingen
Industrieel
-Het wordt gebruikt bij de vervaardiging van glas, met name als bleekmiddel. Het wordt ook gebruikt bij de vervaardiging van keramiek, elektronische producten en vuurwerk.
-Het wordt als een ondergeschikte component toegevoegd aan legeringen op koperbasis om de corrosiebestendigheid van de gelegeerde metalen te vergroten.
-De aastweeOF3 is het uitgangsmateriaal voor de bereiding van elementair arseen, om elektrische verbindingen te verbeteren en voor de productie van arsenidehalfgeleiders
-De aastweeOF3, evenals koperarsenaat worden ze gebruikt als houtconserveringsmiddelen. Het werd gebruikt in combinatie met koperacetaat om het Parijse groene pigment te maken, gebruikt om verven en rodenticiden te maken..
Artsen
-Arseentrioxide is een verbinding die al eeuwen wordt gebruikt bij de behandeling van vele ziekten. Het werd gebruikt als tonicum bij de behandeling van voedingsstoornissen, neuralgie, reuma, artritis, astma, chorea, malaria, syfilis en tuberculose.
-Evenzo is het gebruikt bij de lokale behandeling van huidaandoeningen en wordt het gebruikt om enkele oppervlakkige epitheliomen te vernietigen..
-De oplossing van Fowler werd gebruikt om huidziekten en leukemie te behandelen. Het gebruik van dit geneesmiddel wordt stopgezet..
-In de jaren zeventig deed de Chinese onderzoeker Zhang Tingdong onderzoek naar het gebruik van arseentrioxide bij de behandeling van acute promyelocytische leukemie (APL). Wat leidde tot de productie van het medicijn Trisenox, dat werd goedgekeurd door de Amerikaanse FDA.
-Trisenox is gebruikt bij APL-patiënten die niet reageren op "eerstelijnsbehandeling", bestaande uit all-trans retinoïnezuur (ATRA). Van arseentrioxide is aangetoond dat het kankercellen ertoe aanzet apoptose te ondergaan.
-Trisenox wordt gebruikt als een cytostaticum bij de behandeling van het refractaire promyelocytische subtype (M.3) door APL.
Referenties
- Shen et al. (2001). Onderzoek naar de klinische werkzaamheid en farmacokinetiek van laaggedoseerde arseentrioxide bij de behandeling van recidiverende acute promyelocytische leukemie: een vergelijking met conventionele dosering. Leukemie 15, 735-741.
- Science Direct. (2014). Arseentrioxide. De Sevier. Hersteld van: sciencedirect.com
- Wikipedia. (2019). Arseentrioxide. Hersteld van: en.wikipedia.org
- PubChem. (2019). Arseen (III) oxide. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta en Steven L. Soignetb. (2001). Risico-batenprofiel van arseentrioxide. The Oncologist vol. 6 Supplement 2 29-32.
- The New England Journal of Medicine. (11 juli 2013). Retinoïnezuur en arseentrioxide voor acute promyelocytische leukemie. n nederlands j med 369; 2.
Niemand heeft nog op dit artikel gereageerd.