
Primaire koolstofkenmerken, soorten en voorbeelden
De primaire koolstof Het is er een die in elke verbinding, ongeacht de moleculaire omgeving, een binding vormt met ten minste één ander koolstofatoom. Deze binding kan enkel, dubbel (=) of drievoudig (≡) zijn, zolang er maar twee koolstofatomen zijn verbonden en op aangrenzende posities (logisch).
De waterstofatomen die op deze koolstof aanwezig zijn, worden primaire waterstofatomen genoemd. De chemische eigenschappen van de primaire, secundaire en tertiaire waterstofatomen verschillen echter weinig en zijn voornamelijk onderhevig aan de moleculaire omgeving van koolstof. Het is om deze reden dat primaire koolstof (1 °) gewoonlijk met meer belang wordt behandeld dan zijn waterstofatomen.
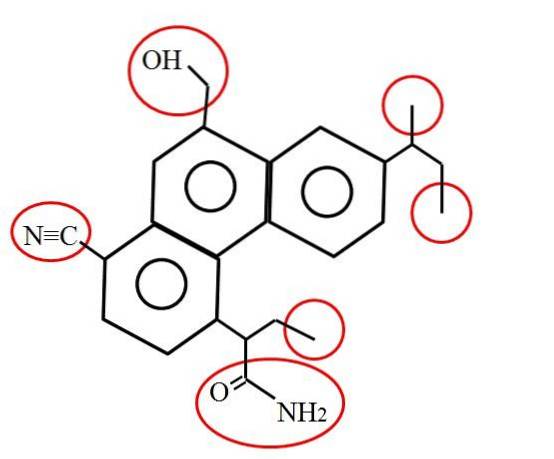
En hoe ziet een primaire koolstof eruit? Het antwoord hangt, zoals gezegd, af van uw moleculaire of chemische omgeving. De afbeelding hierboven geeft bijvoorbeeld de primaire koolstofatomen aan, omsloten door rode cirkels, in de structuur van een hypothetisch (hoewel waarschijnlijk echt) molecuul..
Als je goed kijkt, zul je zien dat er drie identiek zijn; terwijl de andere drie totaal verschillend zijn. De eerste drie bestaan uit methylgroepen, -CH3 (rechts van het molecuul), en de andere zijn de methylolgroepen, -CHtweeOH, nitril, -CN en een amide, RCONHtwee (links van het molecuul en eronder).
Artikel index
- 1 Kenmerken van primair koolstof
- 1.1 Locatie en links
- 1.2 Lage sterische belemmering
- 1.3 Reactiviteit
- 2 soorten
- 3 voorbeelden
- 3.1 Aldehyden en carbonzuren
- 3.2 In lineaire aminen
- 3.3 In alkylhalogeniden
- 4 referenties
Kenmerken van primair koolstof
Locatie en links
Zes primaire koolstofatomen werden hierboven getoond, zonder enige andere opmerking dan hun locaties en welke andere atomen of groepen hen vergezellen. Ze kunnen overal in de structuur zijn, en waar ze ook zijn, ze markeren het "einde van de weg"; dat wil zeggen, waar een deel van het skelet eindigt. Dit is de reden waarom ze soms terminale koolstofatomen worden genoemd..
Het is dus duidelijk dat de groepen -CH3 ze zijn terminaal en hun koolstof is 1 °. Merk op dat deze koolstof zich bindt aan drie waterstofatomen (die in de afbeelding zijn weggelaten) en aan een enkele koolstof, waardoor hun respectievelijke vier bindingen worden voltooid..
Daarom worden ze allemaal gekenmerkt door een C-C-binding, een binding die ook dubbel kan zijn (C = CHtwee) of drievoudig (C≡CH). Dit blijft waar zelfs als er andere atomen of groepen aan deze koolstofatomen zijn gehecht; net als bij de andere drie resterende koolstofatomen van 1 ° in de afbeelding.
Lage sterische belemmering
Er werd vermeld dat de primaire koolstofatomen terminaal zijn. Door het einde van een stuk van het skelet te signaleren, interfereren geen andere atomen er ruimtelijk mee. Bijvoorbeeld de groepen -CH3 ze kunnen een interactie aangaan met atomen van andere moleculen; maar hun interacties met naburige atomen van hetzelfde molecuul zijn laag. Hetzelfde geldt voor de -CHtweeOH en -CN.
Dit komt doordat ze praktisch worden blootgesteld aan "vacuüm". Daarom vertonen ze over het algemeen een lage sterische hinder in vergelijking met de andere soorten koolstof (2e, 3e en 4e).
Er zijn echter uitzonderingen, het product van een moleculaire structuur met te veel substituenten, hoge flexibiliteit of de neiging om zichzelf in te sluiten..
Reactiviteit
Een van de gevolgen van de lagere sterische hinder rond de 1e koolstof is een grotere blootstelling om te reageren met andere moleculen. Hoe minder atomen het pad van het aanvallende molecuul ernaartoe belemmeren, des te waarschijnlijker zal de reactie zijn..
Maar dit is alleen waar vanuit een sterisch oogpunt. Eigenlijk is de belangrijkste factor de elektronische; dat wil zeggen, wat is de omgeving van genoemde koolstofatomen 1 °.
De koolstof grenzend aan de primaire, draagt een deel van zijn elektronische dichtheid eraan over; en hetzelfde kan gebeuren in de tegenovergestelde richting, waardoor een bepaald type chemische reactie wordt bevorderd.
De sterische en elektronische factoren verklaren dus waarom het gewoonlijk het meest reactief is; hoewel er niet echt een algemene reactiviteitsregel is voor alle primaire koolstofatomen.
Types
Primaire koolstofatomen missen een intrinsieke classificatie. In plaats daarvan worden ze geclassificeerd op basis van de groepen atomen waartoe ze behoren of waaraan ze zijn gebonden; Dit zijn de functionele groepen. En aangezien elke functionele groep een specifiek type organische verbinding definieert, zijn er verschillende primaire koolstofatomen.
Bijvoorbeeld de groep -CHtweeOH is afgeleid van de primaire alcohol RCHtweeOH. Primaire alcoholen bestaan dus uit 1 ° koolstofatomen die gebonden zijn aan de hydroxylgroep, -OH.
De nitrilgroep, -CN of -C≡N, kan daarentegen alleen rechtstreeks aan een koolstofatoom worden gehecht door de enkele C-CN-binding. Het bestaan van secundaire nitrilen (R.tweeCN) of veel minder tertiair (R3CN).
Een soortgelijk geval doet zich voor met de substituent afgeleid van het amide, -CONHtwee. Het kan substituties van de waterstofatomen van het stikstofatoom ondergaan; maar zijn koolstof kan alleen binden aan een andere koolstof, en daarom zal het altijd als primair worden beschouwd, C-CONHtwee.
En met betrekking tot de -CH-groep3, Het is een alkylvervanger die alleen kan binden aan een andere koolstof en daarom primair is. Als de ethylgroep wordt beschouwd, -CHtweeCH3, het valt meteen op dat de CHtwee, methyleengroep, is een 2 ° koolstofatoom omdat het is gekoppeld aan twee koolstofatomen (C-CHtweeCH3.
Voorbeelden
Aldehyden en carbonzuren
Er zijn enkele voorbeelden van primaire koolstofatomen genoemd. Naast hen is er het volgende paar groepen: -CHO en -COOH, respectievelijk formyl en carboxyl genaamd. De koolstofatomen van deze twee groepen zijn primair, omdat ze altijd verbindingen zullen vormen met de formules RCHO (aldehyden) en RCOOH (carbonzuren).
Dit paar is nauw verwant aan elkaar vanwege de oxidatiereacties die de formylgroep ondergaat om in carboxyl te veranderen:
RCHO => RCOOH
Reactie op aldehyden of de -CHO-groep als het als substituent in een molecuul is.
In lineaire aminen
De classificatie van aminen hangt uitsluitend af van de substitutiegraad van de waterstofatomen van de -NH-groeptwee. In lineaire aminen kunnen echter primaire koolstofatomen worden waargenomen, zoals in propanamine:
CH3-CHtwee-CHtwee-NHtwee
Merk op dat de CH3 het zal altijd een 1e koolstof zijn, maar dit keer de CHtwee aan de rechterkant is ook 1 ° omdat het is gebonden aan een enkele koolstof en de NH-groeptwee.
In alkylhalogeniden
Een voorbeeld dat erg lijkt op het vorige wordt gegeven met de alkylhalogeniden (en in vele andere organische verbindingen). Stel dat broompropaan:
CH3-CHtwee-CHtwee-Br
Daarin blijven de primaire koolstofatomen hetzelfde.
Concluderend, de 1 ° koolstofatomen overstijgen het type organische verbinding (en zelfs organometaal), omdat ze in elk van hen aanwezig kunnen zijn en eenvoudig worden geïdentificeerd omdat ze zijn gekoppeld aan een enkele koolstofatoom..
Referenties
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10th editie.). Wiley plus.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Morrison, R. T. en Boyd, R. N. (1987). Organische chemie. (5ta Editie). Redactioneel Addison-Wesley Interamericana.
- Ashenhurst J. (16 juni 2010). Primair, secundair, tertiair, quartair in organische chemie. Master Organische Chemie. Hersteld van: masterorganicchemistry.com
- Wikipedia. (2019). Primaire koolstof. Hersteld van: en.wikipedia.org



Niemand heeft nog op dit artikel gereageerd.