
Eigenschappen, risico's en toepassingen van arseenzuur (H3AsO4)
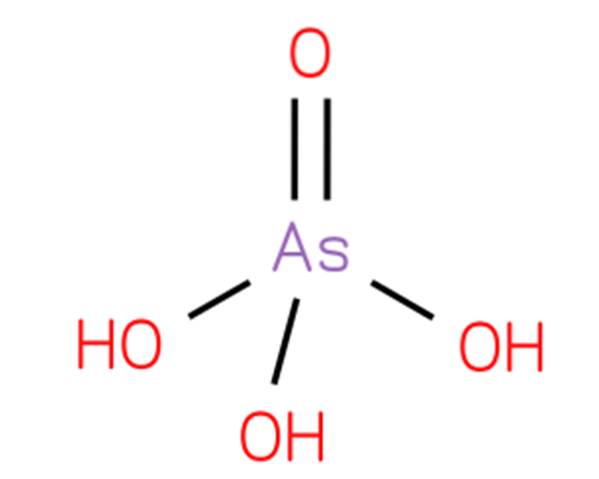
De arseenzuur, waterstofarsenaat of orthoarseenzuur, is een chemische verbinding waarvan de formule H3AsO4 is. Een arseenoxzuur omvat een oxogroep en drie hydroxylgroepen die aan een centraal arseenatoom zijn gehecht. De structuur is weergegeven in figuur 1 (CHEBI: 18231 - arseenzuur, S.F.).
De structuur is analoog aan fosforzuur (Royal Society of Chemistry, 2015) en kan worden herschreven als AsO (OH) 3. Deze verbinding wordt bereid door arseentrioxide te behandelen met stikstofmonoxide volgens de reactie: As2O3 + 2HNO3 + 2H2O → 2H3AsO4 + N2O3.
De resulterende oplossing wordt afgekoeld om kleurloze kristallen van het hemihydraat H3AsO4 · ½H2O te geven, hoewel het dihydraat H3AsO4 · 2H2O optreedt wanneer kristallisatie plaatsvindt bij lagere temperaturen (Budavari, 1996).
Arseenzuur is een uiterst giftige verbinding. Veel veiligheidsinformatiebladen adviseren om contact indien mogelijk te vermijden.
Artikel index
- 1 Fysische en chemische eigenschappen van arseenzuur
- 2 Reactiviteit en gevaren
- 2.1 In geval van contact met de ogen
- 2.2 Bij huidcontact
- 2.3 Bij inslikken
- 2.4 Bij inademing
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen van arseenzuur
Arseenzuur is een witte hygroscopische vaste stof. Het uiterlijk wordt getoond in figuur 2.

In waterige oplossing is het een stroperige en transparante hygroscopische vloeistof (National Center for Biotechnology Information., 2017). Het molecuulgewicht is 141,94 g / mol en de dichtheid is 2,5 g / ml. Het smeltpunt is 35,5 ° C en het kookpunt is 120 ° C waar het uiteenvalt.
Arseenzuur is zeer goed oplosbaar in water, het kan 16,7 g per 100 ml oplossen, het is ook oplosbaar in alcohol. De verbinding heeft een pKa van 2,19 voor de eerste deprotonering en 6,94 en 11,5 voor de tweede en derde deprotonering (Royal Society of Chemistry, 2015).
Arseenzuur is een oxidatiemiddel. Kan staal aantasten en reageert met gegalvaniseerde metalen en messing.
Arseenzuuroplossingen kunnen bij contact met actieve metalen, zoals zink en aluminium, zeer giftig gasvormig arsine (AsH3) ontwikkelen. Bij verhitting tot ontbinding, produceert het giftige dampen van metallisch arseen.
De oplossing is licht zuur en een zwak oxidatiemiddel. Reageert met basen om wat warmte te genereren en arsenaten neer te slaan (ARSENIC ACID, LIQUID, 2016).
Reactiviteit en gevaren
Arseenzuur is een stabiele, onbrandbare verbinding die bijtend kan zijn voor metalen. De verbinding is zeer giftig en een bevestigde kankerverwekkende stof voor mensen.
Inademing, inslikken of huidcontact met materiaal kan ernstig letsel of de dood tot gevolg hebben. Contact met de gesmolten stof kan ernstige brandwonden aan huid en ogen veroorzaken..
Aanraking met de huid vermijden. De effecten van contact of inademing kunnen vertraagd zijn. Bij brand kunnen irriterende, bijtende en / of giftige gassen vrijkomen. Afvalwater van brandbestrijdings- of verdunningsproducten kan corrosief en / of giftig zijn en verontreiniging veroorzaken.
Symptomen van arseenzuurvergiftiging zijn hoesten en kortademigheid bij inademing. Er kan ook roodheid op de huid, pijn en een branderig gevoel optreden als deze ermee in contact komt. Ten slotte zijn de symptomen bij inslikken roodheid en pijn in de ogen, keelpijn, misselijkheid, braken, diarree en toevallen..
In geval van contact met de ogen
Ze moeten gedurende ten minste 15 minuten met veel water worden gewassen, waarbij de bovenste en onderste oogleden sporadisch worden opgetild totdat er geen sporen meer zijn van chemische resten..
Bij huidcontact
Onmiddellijk met veel water en zeep wassen gedurende tenminste 15 minuten, terwijl verontreinigde kleding en schoenen worden verwijderd. Bedek brandwonden met een droog, steriel verband (veilig, niet strak).
Bij inslikken
Mond spoelen en slachtoffer bij bewustzijn grote hoeveelheden water geven om zuur te verdunnen. In dat geval moet maagspoeling worden toegepast en mag braken niet worden opgewekt..
Bij inademing
Indien nodig moet kunstmatige beademing worden gegeven. De mond-op-mond-methode mag niet worden gebruikt als het slachtoffer de stof heeft ingeslikt of ingeademd..
Kunstmatige beademing moet worden uitgevoerd met behulp van een zakmasker voorzien van een eenrichtingsklep of een ander geschikt medisch beademingsapparaat. Het slachtoffer moet naar een koele plaats worden verplaatst en warm en rustig worden gehouden..
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen (National Institute for Occupational Safety and Health, 2015).
Arseenzuur is schadelijk voor het milieu. De stof is zeer giftig voor in het water levende organismen. Er moeten maatregelen worden genomen om de afgifte van deze chemische verbinding te beperken.
Toepassingen
Arseenzuur heeft, gezien zijn hoge toxiciteit, beperkte toepassingen. Deze verbinding werd echter gebruikt als pesticide en grondontsmettingsmiddel, hoewel het momenteel verouderd is (University of Hertfordshire, 2016).
Het wordt ook gebruikt bij de houtverwerking en als droogmiddel bij de katoenproductie sinds 1995. Door de planten te sproeien, drogen de bladeren snel zonder eraf te vallen. De plant moet droog genoeg zijn zodat de katoenen bollen er gemakkelijk uit kunnen komen.
Arseenzuur wordt gebruikt bij de productie van glas. Hoewel de gegevens de stof als tussenproduct beschouwen, lijkt dit gebruik van arseenzuur meer op een "verwerkingsmiddel", vergelijkbaar met het gebruik van diarseentrioxide (As2O3) als afwerkingsmiddel..
Deze verbinding verbreekt de zuurstofverbindingen tussen andere elementen door de redoxreactie en produceert gasvormige zuurstof die helpt bij het elimineren van bellen in het glas (Position Paper of the European Glass Industries on the, 2012).
Arsanilzuur of 4-aminofenylarsonzuur is een derivaat van orthoarseenzuur. Het wordt gebruikt als een arseen antibacterieel diergeneesmiddel dat wordt gebruikt bij de preventie en behandeling van varkensdysenterie (ARSENIC ACID, S.F.).
Arsenaat is het zout of de ester van arseenzuur met een negatief ion van AsO43-. Arsenaat lijkt in veel opzichten op fosfaat, aangezien arseen en fosfor in dezelfde groep (kolom) van het periodiek systeem voorkomen..
Arsenaat kan anorganisch fosfaat vervangen in de glycolyse-fase die 1,3-bisfosfoglyceraat produceert en in plaats daarvan 1-arseen-3-fosfoglyceraat produceert. Dit molecuul is onstabiel en hydrolyseert snel en vormt onderweg het volgende tussenproduct, 3-fosfoglyceraat..
Daarom gaat de glycolyse door, maar het ATP-molecuul dat zou worden gegenereerd uit 1,3-bisfosfoglyceraat gaat verloren. Arsenaat is een ontkoppelaar voor glycolyse, wat de toxiciteit ervan verklaart.
Sommige soorten bacteriën verkrijgen hun energie door verschillende brandstoffen te oxideren en tegelijkertijd arsenaat te reduceren tot arsenieten. De betrokken enzymen staan bekend als arsenaatreductasen..
In 2008 werden bacteriën ontdekt die een versie van fotosynthese gebruiken met arsenieten als elektronendonor, waarbij arsenaat wordt geproduceerd (net zoals bij gewone fotosynthese water wordt gebruikt als elektronendonor, waarbij moleculaire zuurstof wordt geproduceerd).
Onderzoekers vermoedden dat deze fotosynthetische organismen historisch gezien het arsenaat produceerden waardoor de arsenaatreducerende bacteriën konden gedijen (Human Metabolome Database, 2017).
Referenties
- ARSEENZUUR. (S.F.). Opgehaald van chemicalland21.com.
- ARSENINEZUUR, VLOEISTOF. (2016). Opgehaald van cameochemicals.noaa.gov.
- Budavari, S. (. (1996). Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. Whitehouse Station, NJ: Merck and Co.
- CHEBI: 18231 - arseenzuur. (S.F.). Hersteld van ebi.ac.uk.
- Database met menselijke metabolieten. (2017, 2 maart). Metabocard voor Arsenate laten zien. Hersteld van hmdb.ca.
- Nationaal centrum voor informatie over biotechnologie ... (2017, 4 maart). PubChem samengestelde database; CID = 234,. Opgehaald van PubChem.
- Nationaal instituut voor veiligheid en gezondheid op het werk. (2015, 22 juli). ARSEENZUUR. Hersteld van cdc.gov.
- Position Paper van de European Glass Industries over de. (2012, 18 september). Hersteld van glassallianceeurope.
- Royal Society of Chemistry. (2015). Arseenzuur. Hersteld van chemspider.
- Royal Society of Chemistry. (2015). Fosforzuur. Hersteld van chemspider.
- Universiteit van Hertfordshire. (2016, 13 januari). arseenzuur. Hersteld van PPDB.



Niemand heeft nog op dit artikel gereageerd.