
Wat is spectrale notatie?
De spectrale notatie is de rangschikking van elektronen in energieniveaus rond de kern van een atoom. Volgens het oude atoommodel van Bohr bezetten elektronen verschillende niveaus in banen rond de kern, van de eerste schaal die zich het dichtst bij de kern bevindt, K, tot de zevende schaal, Q, die het verst van de kern verwijderd is..
In termen van een meer verfijnd kwantummechanisch model, zijn de K-Q-schalen onderverdeeld in een reeks orbitalen, die elk kunnen worden bezet door niet meer dan één paar elektronen..

Gewoonlijk wordt de elektronenconfiguratie gebruikt om de orbitalen van een atoom in zijn grondtoestand te beschrijven, maar het kan ook worden gebruikt om een atoom weer te geven dat is geïoniseerd tot een kation of anion, waarmee het verlies of de toename van elektronen in hun respectieve orbitalen wordt gecompenseerd. ..
Veel van de fysische en chemische eigenschappen van elementen kunnen worden gecorreleerd met hun unieke elektronische configuraties. Valentie-elektronen, de elektronen in de buitenste schil, zijn de bepalende factor voor de unieke chemie van het element..
Wanneer elektronen in de buitenste schil van een atoom een of andere vorm van energie ontvangen, gaan ze naar hogere energielagen. Aldus zal een elektron in de K-schaal worden overgebracht naar de L-schaal die zich in een staat van hogere energie bevindt.
Wanneer het elektron terugkeert naar zijn grondtoestand, geeft het de energie vrij die het heeft geabsorbeerd door een elektromagnetisch spectrum (licht) uit te zenden. Omdat elk atoom een specifieke elektronische configuratie heeft, zal het ook een specifiek spectrum hebben dat het absorptie- (of emissiespectrum) wordt genoemd..
Om deze reden wordt de term spectrale notatie gebruikt om te verwijzen naar de elektronenconfiguratie.
Hoe spectrale notatie te bepalen: kwantumgetallen
In totaal worden vier kwantumgetallen gebruikt om de beweging en trajecten van elk elektron in een atoom volledig te beschrijven..
De combinatie van alle kwantumgetallen van alle elektronen in een atoom wordt beschreven door een golffunctie die voldoet aan de Schrödingervergelijking. Elk elektron in een atoom heeft een unieke reeks kwantumgetallen.
Volgens het Pauli Exclusion Principle kunnen twee elektronen niet dezelfde combinatie van vier kwantumgetallen delen.
Kwantumgetallen zijn belangrijk omdat ze kunnen worden gebruikt om de elektronenconfiguratie van een atoom en de waarschijnlijke locatie van de elektronen in het atoom te bepalen..
Kwantumgetallen worden ook gebruikt om andere kenmerken van atomen te bepalen, zoals ionisatie-energie en atoomradius..
Kwantumnummers duiden specifieke schalen, subschalen, orbitalen en spins van elektronen aan.
Dit betekent dat ze de kenmerken van een elektron in een atoom volledig beschrijven, dat wil zeggen dat ze elke unieke oplossing van de Schrödingervergelijking of de golffunctie van elektronen in een atoom beschrijven..
Er zijn in totaal vier kwantumgetallen: het hoofdkwantumgetal (n), het baanimpulsmomentkwantumgetal (l), het magnetische kwantumgetal (ml) en het elektronenspinquantumgetal (ms).
Het belangrijkste kwantumgetal, nn, beschrijft de energie van een elektron en de meest waarschijnlijke afstand van het elektron tot de kern. Met andere woorden, het verwijst naar de grootte van de orbitaal en het energieniveau waarop een elektron wordt geplaatst..
Het aantal subshells, of ll, beschrijft de vorm van de orbitaal. Het kan ook worden gebruikt om het aantal hoekknooppunten te bepalen.
Het magnetische kwantumgetal, ml, beschrijft de energieniveaus in een subshell, en ms verwijst naar de spin op het elektron, die omhoog of omlaag kan zijn..
Aufbau-principe
Aufbau komt van het Duitse woord "Aufbauen" wat "bouwen" betekent. Door elektronenconfiguraties te schrijven, bouwen we in wezen elektronenorbitalen terwijl we van het ene atoom naar het andere gaan..
Terwijl we de elektronenconfiguratie van een atoom schrijven, vullen we de orbitalen in oplopende volgorde van atoomnummer.
Het Aufbau-principe komt voort uit het Pauli-uitsluitingsprincipe dat zegt dat er geen twee fermionen (bijvoorbeeld elektronen) in een atoom zijn.
Ze kunnen dezelfde reeks kwantumgetallen hebben, dus moeten ze "stapelen" op hogere energieniveaus. Hoe elektronen zich ophopen, is een kwestie van elektronenconfiguraties.
Stabiele atomen hebben evenveel elektronen als protonen in de kern. Elektronen verzamelen zich rond de kern in kwantumorbitalen volgens vier basisregels die het Aufbau-principe worden genoemd..
- Er zijn geen twee elektronen in het atoom die dezelfde vier kwantumgetallen n, l, m en s delen.
- Elektronen zullen eerst de orbitalen van het laagste energieniveau innemen.
- De elektronen vullen de orbitalen altijd met hetzelfde spinnummer. Als de orbitalen vol zijn, begint het.
- De elektronen vullen orbitalen met de som van de kwantumgetallen n en l. Orbitalen met gelijke waarden van (n + l) worden eerst gevuld met de lagere n-waarden.
De tweede en vierde regel zijn in principe hetzelfde. Een voorbeeld van regel vier zijn de 2p- en 3s-orbitalen.
Een 2p-orbitaal is n = 2 en l = 2 en een 3s-orbitaal is n = 3 en l = 1. (N + l) = 4 in beide gevallen, maar de 2p-orbitaal heeft de laagste energie of de laagste n-waarde en zal vul voor de laag 3s.
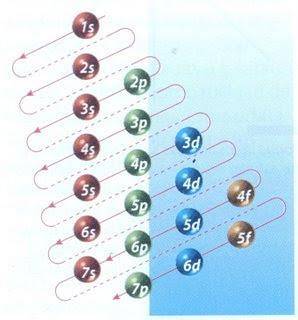
Gelukkig kan het Moeller-diagram in figuur 2 worden gebruikt om elektronenvulling te doen. De grafiek wordt gelezen door de diagonalen vanaf 1s te laten lopen.
Figuur 2 toont de atomaire orbitalen en de pijlen volgen de weg voorwaarts.
Nu bekend is dat de volgorde van de orbitalen is gevuld, is het enige dat overblijft, de grootte van elke orbitaal te onthouden.
S-orbitalen hebben 1 mogelijke waarde van ml om 2 elektronen vast te houden
P-orbitalen hebben 3 mogelijke waarden van ml om 6 elektronen vast te houden
D-orbitalen hebben 5 mogelijke waarden van ml om 10 elektronen vast te houden
F-orbitalen hebben 7 mogelijke waarden van ml om 14 elektronen vast te houden
Dit is alles wat nodig is om de elektronische configuratie van een stabiel atoom van een element te bepalen..
Neem bijvoorbeeld het element stikstof. Stikstof heeft zeven protonen en dus zeven elektronen. De eerste orbitaal die moet worden gevuld, is de 1s-orbitaal. Een s-orbitaal heeft twee elektronen, dus er zijn nog vijf elektronen over.
De volgende orbitaal is de 2s-orbitaal en bevat de volgende twee. De laatste drie elektronen gaan naar de 2p-orbitaal die maximaal zes elektronen kan bevatten.
Honderd regels
Aufbau's sectie besprak hoe elektronen eerst de orbitalen met de laagste energie vullen en vervolgens pas naar de orbitalen met de hoogste energie gaan nadat de orbitalen met de laagste energie zijn gevuld..
Er is echter een probleem met deze regel. Zeker, de 1s-orbitalen moeten vóór de 2s-orbitalen worden gevuld, omdat de 1s-orbitalen een lagere waarde van n hebben, en dus een lagere energie..
En de drie verschillende 2p-orbitalen? In welke volgorde moeten ze worden gevuld? Het antwoord op deze vraag heeft betrekking op de regel van Hund.
De regel van Hund stelt dat:
- Elke orbitaal in een subniveau wordt afzonderlijk bezet voordat een orbitaal dubbel wordt bezet.
- Alle elektronen in afzonderlijk bezette orbitalen hebben dezelfde spin (om de totale spin te maximaliseren).
Wanneer elektronen worden toegewezen aan orbitalen, probeert een elektron eerst alle orbitalen te vullen met vergelijkbare energie (ook wel gedegenereerde orbitalen genoemd) voordat het wordt gekoppeld aan een ander elektron in een halfvolle orbitaal..
Atomen in grondtoestanden hebben de neiging om zoveel mogelijk ongepaarde elektronen te hebben. Bedenk bij het visualiseren van dit proces hoe elektronen hetzelfde gedrag vertonen als dezelfde polen in een magneet als ze in contact zouden komen..
Wanneer negatief geladen elektronen de orbitalen vullen, proberen ze eerst zo ver mogelijk van elkaar weg te komen voordat ze moeten paren..
Referenties
- Anastasiya Kamenko, T. E. (2017, 24 maart). Kwantumgetallen. Opgehaald van chem.libretexts.org.
- Aufbau-principe. (2015, 3 juni). Opgehaald van chem.libretexts.org.
- Elektronenconfiguraties en de eigenschappen van atomen. (S.F.). Opgehaald van oneonta.edu.
- Encyclopædia Britannica. (2011, 7 september). Elektronische configuratie. Opgehaald van britannica.com.
- Helmenstine, T. (2017, 7 maart). Het Aufbau-principe - elektronische structuur en het Aufbau-principe. Opgehaald van thoughtco.com.
- Hund's Rules. (2015, 18 juli). Opgehaald van chem.libretexts.org.
- Spectroscopische notatie. (S.F.). Opgehaald van bcs.whfreeman.com.


Niemand heeft nog op dit artikel gereageerd.