
Broomwaterstofzuur (HBr) structuur, eigenschappen, vorming

De broomwaterstofzuur Het is een anorganische verbinding die het resultaat is van de waterige oplossing van een gas dat waterstofbromide wordt genoemd. De chemische formule is HBr en kan op verschillende gelijkwaardige manieren worden beschouwd: als een moleculair hydride of een waterstofhalogenide in water; dat wil zeggen, een hydracide.
In chemische vergelijkingen moet het worden geschreven als HBr (ac), wat aangeeft dat het het broomwaterstofzuur is en niet het gas. Dit zuur is een van de sterkste bekende, zelfs meer dan zoutzuur, HCl. De verklaring hiervoor ligt in de aard van de covalente band.
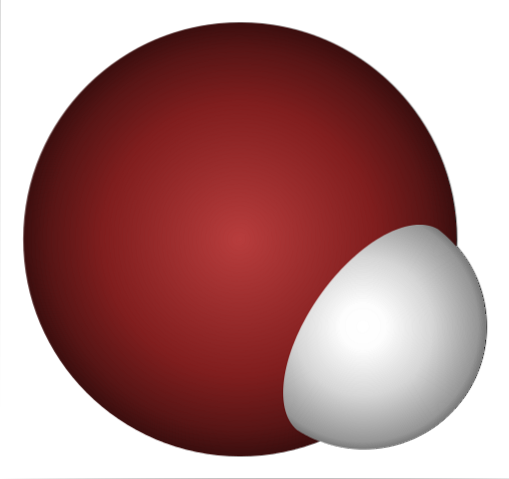
Waarom is HBr zo'n sterk zuur, en nog meer opgelost in water? Omdat de H-Br covalente binding erg zwak is, vanwege de slechte overlap van de 1s-orbitalen van H en 4p van Br.
Dit is niet verwonderlijk als je goed kijkt naar de afbeelding hierboven, waar duidelijk het broomatoom (bruin) veel groter is dan het waterstofatoom (wit).
Bijgevolg zorgt elke verstoring ervoor dat de H-Br-binding breekt, waardoor het H-ion vrijkomt+. Broomwaterstofzuur is dus een Brönsted-zuur, omdat het protonen of waterstofionen overbrengt. Zijn sterkte is zodanig dat het wordt gebruikt bij de synthese van verschillende organobrominated verbindingen (zoals 1-broomethaan, CH3CHtweeBr).
Broomwaterstofzuur is, na joodwaterstofzuur, HI, een van de sterkste en meest bruikbare hydraciden voor de vertering van bepaalde vaste monsters.
Artikel index
- 1 Structuur van broomwaterstofzuur
- 1.1 Zuurheid
- 2 Fysische en chemische eigenschappen
- 2.1 Moleculaire formule
- 2.2 Molecuulgewicht
- 2.3 Fysiek uiterlijk
- 2.4 Geur
- 2.5 Geurdrempelwaarde
- 2.6 Dichtheid
- 2.7 Smeltpunt
- 2.8 Kookpunt
- 2.9 Oplosbaarheid in water
- 2.10 Dampdichtheid
- 2.11 Zuurgraad pKa
- 2.12 Calorische capaciteit
- 2.13 Standaard molaire enthalpie
- 2.14 Standaard molaire entropie
- 2.15 Vlampunt
- 3 Nomenclatuur
- 4 Hoe wordt het gevormd?
- 4.1 Mengsel van waterstof en broom in water
- 4.2 Fosfortribromide
- 4.3 Zwaveldioxide en broom
- 5 toepassingen
- 5.1 Bereiding van bromiden
- 5.2 Synthese van alkylhalogeniden
- 5.3 Katalysator
- 6 referenties
Structuur van broomwaterstofzuur
De afbeelding toont de structuur van H-Br, waarvan de eigenschappen en kenmerken, ook al zijn ze die van gas, nauw verband houden met de waterige oplossingen. Dat is de reden waarom er een punt komt dat er verwarring bestaat over naar welke van de twee verbindingen wordt verwezen: HBr of HBr (ac).
De structuur van HBr (ac) is anders dan die van HBr, aangezien nu de watermoleculen dit diatomische molecuul oplossen. Als het dichtbij genoeg is, wordt de H overgedragen+ naar een molecuul HtweeOf zoals aangegeven in de volgende chemische vergelijking:
HBr + HtweeO => Br-- + H.3OF+
De structuur van broomwaterstofzuur bestaat dus uit Br-ionen-- en H3OF+ elektrostatisch op elkaar inwerken. Nu is het een beetje anders dan de covalente binding van H-Br.
De hoge zuurgraad is te danken aan het volumineuze Br-anion- kan nauwelijks communiceren met de H3OF+, niet kunnen verhinderen dat u de H+ naar een andere omringende chemische soort.
Zuurgraad
Bijvoorbeeld Cl- en de F- hoewel ze geen covalente bindingen met H vormen3OF+, ze kunnen interageren via andere intermoleculaire krachten, zoals waterstofbruggen (die alleen F- kan ze accepteren). Waterstofbruggen F--H-OHtwee+ "Hinder" de schenking van de H+.
Om deze reden is fluorwaterstofzuur, HF, een zwakker zuur. in water dan broomwaterstofzuur; aangezien de ionische interacties Br- H.3OF+ doe geen moeite met de overdracht van de H+.
Hoewel water aanwezig is in HBr (aq), is het gedrag uiteindelijk vergelijkbaar met dat van een H-Br-molecuul; dat wil zeggen, een H+ wordt overgedragen van HBr of Br-H.3OF+.
Fysische en chemische eigenschappen
Moleculaire formule
HBr.
Molecuulgewicht
80,972 g / mol. Merk op dat, zoals vermeld in de vorige sectie, alleen het HBr wordt beschouwd en niet het watermolecuul. Als het molecuulgewicht is overgenomen uit de formule Br-H.3OF+ zou een waarde hebben van ongeveer 99 g / mol.
Fysiek uiterlijk
Kleurloze of lichtgele vloeistof, die afhangt van de concentratie van het opgeloste HBr. Hoe geler het is, hoe geconcentreerder en gevaarlijker het zal zijn.
Geur
Scherp, irriterend.
Geurdrempel
6,67 mg / m3.
Dichtheid
1,49 g / cm3 (48% w / w waterige oplossing). Deze waarde, evenals de waarde die overeenkomt met het smelt- en kookpunt, is afhankelijk van de hoeveelheid HBr die in het water is opgelost..
Smeltpunt
-11 ° C (12 ° F, 393 ° K) (49% w / w waterige oplossing).
Kookpunt
122 ºC (252 ºF, 393 ºK) bij 700 mmHg (waterige oplossing 47-49% w / w).
Oplosbaarheid in water
-221 g / 100 ml (bij 0 ° C).
-204 g / 100 ml (15 ºC).
-130 g / 100 ml (100 ºC).
Deze waarden hebben betrekking op gasvormig HBr, niet op broomwaterstofzuur. Zoals te zien is, neemt de oplosbaarheid van HBr af naarmate de temperatuur stijgt; gedrag dat natuurlijk is in gassen. Als daarom geconcentreerde HBr (aq) -oplossingen nodig zijn, is het beter om ermee te werken bij lage temperaturen..
Als u bij hoge temperaturen werkt, zal het HBr ontsnappen in de vorm van gasvormige diatomische moleculen, dus de reactor moet worden afgedicht om lekkage te voorkomen.
Dampdichtheid
2,71 (ten opzichte van lucht = 1).
Zuurgraad pKa
-9.0. Deze negatieve constante is een indicatie van zijn grote zuurgraad..
Calorische capaciteit
29,1 kJ / mol.
Standaard molaire enthalpie
198,7 kJ / mol (298 ºK).
Standaard molaire entropie
-36,3 kJ / mol.
ontstekingspunt
Niet brandbaar.
Nomenclatuur
De naam 'broomwaterstofzuur' combineert twee feiten: de aanwezigheid van water en dat broom heeft een valentie van -1 in de verbinding. In het Engels is het wat duidelijker: broomwaterstofzuur, waarbij het voorvoegsel 'hydro' (of hydro) verwijst naar water; hoewel het in feite ook kan verwijzen naar waterstof.
Broom heeft een valentie van -1 omdat het gebonden is aan een waterstofatoom dat minder elektronegatief is dan het; maar als het gebonden was aan of interactie had met zuurstofatomen, kan het talrijke valenties hebben, zoals: +2, +3, +5 en +7. Met de H kan het maar één valentie aannemen, en daarom wordt het achtervoegsel -ico aan de naam toegevoegd.
Hoewel HBr (g), waterstofbromide, watervrij is; dat wil zeggen, het heeft geen water. Daarom wordt het genoemd onder andere nomenclatuurstandaarden, die overeenkomen met die van waterstofhalogeniden..
Hoe wordt het gevormd?
Er zijn verschillende synthetische methoden om broomwaterstofzuur te bereiden. Sommige ervan zijn:
Mengsel van waterstof en broom in water
Zonder de technische details te beschrijven, kan dit zuur worden verkregen door het direct mengen van waterstof en broom in een reactor gevuld met water..
H.twee + Brtwee => HBr
Op deze manier lost het HBr op in het water terwijl het wordt gevormd; dit kan het in de destillaties slepen, zodat oplossingen met verschillende concentraties kunnen worden geëxtraheerd. Waterstof is een gas en broom is een donkerrode vloeistof.
Fosfortribromide
In een uitgebreider proces worden zand, gehydrateerde rode fosfor en broom gemengd. Watervallen worden in ijsbaden geplaatst om te voorkomen dat HBr ontsnapt en in plaats daarvan broomwaterstofzuur vormt. De reacties zijn:
2P + 3Brtwee => 2 PB3
PBr3 + 3HtweeO => 3HBr + H3PO3
Zwaveldioxide en broom
Een andere manier om het te bereiden, is door broom te laten reageren met zwaveldioxide in water:
Brtwee + SWtwee + 2HtweeO => 2HBr + HtweeSW4
Dit is een redoxreactie. De BRtwee het vermindert, verkrijgt elektronen door zich te binden met waterstofatomen; terwijl de SOtwee oxideert, verliest elektronen, wanneer het meer covalente bindingen vormt met andere zuurstofatomen, zoals in zwavelzuur.
Toepassingen
Bromide voorbereiding
Bromidezouten kunnen worden bereid door HBr (aq) te laten reageren met een metaalhydroxide. Er wordt bijvoorbeeld rekening gehouden met de productie van calciumbromide:
Ca (OH)twee + 2HBr => CaBrtwee + H.tweeOF
Een ander voorbeeld is voor natriumbromide:
NaOH + HBr => NaBr + HtweeOF
Zo kunnen veel van de anorganische bromiden worden bereid.
Synthese van alkylhalogeniden
En hoe zit het met organische bromiden? Dit zijn organobroomverbindingen: RBr of ArBr.
Uitdroging van alcohol
De grondstof om ze te verkrijgen kunnen alcoholen zijn. Wanneer ze worden geprotoneerd door de zuurgraad van HBr, vormen ze water, wat een goede vertrekkende groep is, en in plaats daarvan wordt het omvangrijke Br-atoom opgenomen, dat covalent zal worden gebonden met koolstof:
ROH + HBr => RBr + HtweeOF
Deze dehydratatie wordt uitgevoerd bij temperaturen boven 100 ° C, met als doel het verbreken van de R-OH-binding te vergemakkelijken.twee+.
Toevoeging aan alkenen en alkynen
Het HBr-molecuul kan vanuit zijn waterige oplossing worden toegevoegd aan de dubbele of drievoudige binding van een alkeen of alkyn:
RtweeC = CRtwee + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
Er kunnen verschillende producten worden verkregen, maar onder eenvoudige omstandigheden wordt het product voornamelijk gevormd waar het broom is gebonden aan een secundaire, tertiaire of quaternaire koolstof (regel van Markovnikov).
Deze halogeniden zijn betrokken bij de synthese van andere organische verbindingen en hun toepassingsgebied is zeer uitgebreid. Evenzo kunnen sommige ervan zelfs worden gebruikt bij de synthese of het ontwerp van nieuwe geneesmiddelen..
Ether splitsing
Uit de ethers kunnen gelijktijdig twee alkylhalogeniden worden verkregen, die elk een van de twee zijketens R of R 'van de oorspronkelijke ether R-O-R' dragen. Er gebeurt iets dat lijkt op de uitdroging van alcoholen, maar hun reactiemechanisme is anders.
De reactie kan worden geschetst met de volgende chemische vergelijking:
ROR '+ 2HBr => RBr + R'Br
En er komt ook water vrij.
Katalysator
De zuurgraad is zodanig dat het kan worden gebruikt als een effectieve zuurkatalysator. In plaats van het anion Br- aan de moleculaire structuur, maakt plaats voor een ander molecuul om het te doen.
Referenties
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10th editie.). Wiley plus.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Steven A. Hardinger. (2017). Geïllustreerde verklarende woordenlijst van organische chemie: broomwaterstofzuur. Hersteld van: chem.ucla.edu
- Wikipedia. (2018). Broomwaterstofzuur. Hersteld van: en.wikipedia.org
- PubChem. (2018). Broomwaterstofzuur. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Nationaal instituut voor veiligheid en hygiëne op het werk. (2011). Waterstofbromide. [Pdf]. Hersteld van: insht.es
- PrepChem. (2016). Bereiding van broomwaterstofzuur. Hersteld van: prepchem.com



Niemand heeft nog op dit artikel gereageerd.