
Waterstofselenide (H2Se) structuur, eigenschappen en toepassingen

De waterstof selenium of waterstofselenide is een anorganische verbinding waarvan de chemische formule H istweeIk weet. Het is covalent van aard en onder normale temperatuur- en drukomstandigheden is het een kleurloos gas; maar met een sterke geur die herkenbaar is aan zijn mindere aanwezigheid. Chemisch gezien is het een chalcogenide, dus selenium heeft een valentie van -2 (Setwee-.
Van alle seleniden is de H.tweeHet is het meest giftig omdat het molecuul klein is en het seleniumatoom minder sterische hinder heeft bij het reageren. Aan de andere kant zorgt de geur ervoor dat degenen die ermee werken, het ter plaatse kunnen detecteren in geval van een lek buiten de laboratoriumkap..
Waterstofselenide kan worden gesynthetiseerd door de directe combinatie van de twee elementen: moleculaire waterstof, H.twee, en metallisch selenium. Het kan ook worden verkregen door seleniumrijke verbindingen, zoals ijzer (II) selenide, FeSe, op te lossen in zoutzuur..
Aan de andere kant wordt waterstofselenide bereid door waterstofselenide op te lossen in water; dat wil zeggen, de eerste wordt opgelost in water, terwijl de tweede bestaat uit gasvormige moleculen.
Het belangrijkste gebruik ervan is om een bron van selenium te zijn bij organische en anorganische synthese.
Artikel index
- 1 Structuur van waterstofselenide
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molecuulmassa
- 2.3 Kookpunt
- 2.4 Smeltpunt
- 2.5 Dampspanning
- 2.6 Dichtheid
- 2,7 pKa
- 2.8 Oplosbaarheid in water
- 2.9 Oplosbaarheid in andere oplosmiddelen
- 3 Nomenclatuur
- 3.1 Selenide of hydride?
- 4 toepassingen
- 4.1 Metabool
- 4.2 Industrieel
- 5 referenties
Structuur van waterstofselenide
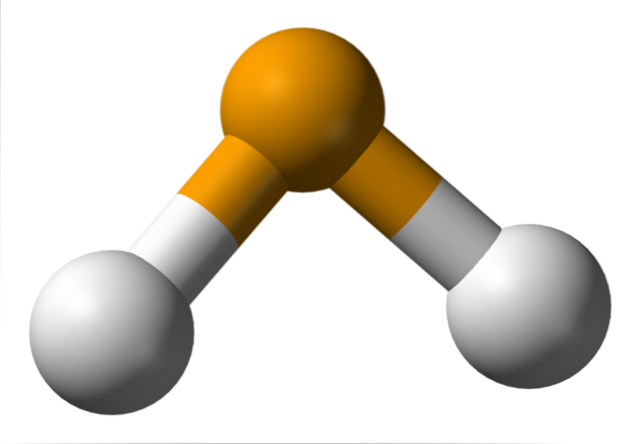
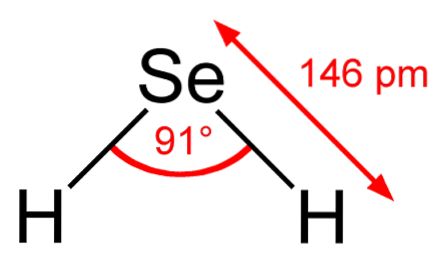
In de bovenste afbeelding is te zien dat het molecuul van HtweeHet heeft een hoekige geometrie, hoewel de hoek van 91 ° ervoor zorgt dat het meer op een L dan op een V lijkt. In dit model van bollen en staven zijn de waterstof- en seleniumatomen respectievelijk de witte en gele bollen..
Dit molecuul is, zoals weergegeven, het molecuul in de gasfase; dat wil zeggen voor waterstofselenide. Wanneer het wordt opgelost in water, geeft het een proton af en in oplossing hebben we het paar HSe- H.3OF+dit paar ionen wordt waterstofselenide, aangeduid als HtweeSe (ac) om het te onderscheiden van waterstofselenide, H.tweeSe (g).
Daarom zijn de structuren tussen de HtweeSe (ac) en HtweeSe (g) zijn heel verschillend; de eerste is omgeven door een waterige bol en vertoont ionische ladingen, en de tweede bestaat uit een agglomeraat van moleculen in de gasfase.
Moleculen van H.tweeZe kunnen nauwelijks met elkaar interageren door zeer zwakke dipool-dipoolkrachten. Selenium, hoewel het minder elektronegatief is dan zwavel, concentreert een hogere elektronendichtheid door het "weg te nemen" van de waterstofatomen..
Selenium hydrides tabletten
Als de moleculen van HtweeZe worden onderworpen aan een buitengewone druk (honderden GPa), theoretisch worden ze gedwongen te stollen door de vorming van Se-H-Se-bindingen; Dit zijn bindingen van drie centra en twee elektronen (3c-2e) waar waterstof aan deelneemt. Daarom beginnen de moleculen polymere structuren te vormen die een vaste stof definiëren..
Onder deze omstandigheden kan de vaste stof worden verrijkt met meer waterstof, wat de resulterende structuren volledig verandert. Bovendien wordt de compositie type HnSe, waarbij n varieert van 3 tot 6. Seleniumhydriden die door deze drukken worden gecomprimeerd en in aanwezigheid van waterstof, hebben dus de chemische formule H3Zie voor H6ik weet.
Deze met waterstof verrijkte seleniumhydriden hebben naar schatting supergeleidende eigenschappen.
Eigendommen
Fysiek uiterlijk
Kleurloos gas dat bij lage temperaturen naar rotte radijs en rotte eieren ruikt als de concentratie toeneemt. De geur is erger en intenser dan die van waterstofsulfide (wat al behoorlijk onaangenaam is). Dit is echter een goede zaak, omdat het de gemakkelijke detectie helpt en het risico op langdurig contact of inademing vermindert..
Wanneer het brandt, geeft het een blauwachtig vlamproduct af van de elektronische interacties in de seleniumatomen.
Moleculaire massa
80,98 g / mol.
Kookpunt
-41 ° C.
Smeltpunt
-66 ° C.
Dampdruk
9,5 atm bij 21 ° C.
Dichtheid
3.553 g / l.
pKnaar
3.89.
Oplosbaarheid in water
0,70 g / 100 ml. Dit bevestigt het feit dat het seleniumatoom van HtweeKan geen merkbare waterstofbruggen vormen met watermoleculen.
Oplosbaarheid in andere oplosmiddelen
-Oplosbaar in CStwee, wat niet verwonderlijk is vanwege de chemische analogie tussen selenium en zwavel.
-Oplosbaar in fosgeen (bij lage temperaturen, aangezien het kookt bij 8 ° C).
Nomenclatuur
Zoals al uitgelegd in de vorige paragrafen, varieert de naam van deze verbinding afhankelijk van het feit of HtweeHet bevindt zich in de gasfase of is opgelost in water. Als het in water zit, wordt het waterstofselenide genoemd, wat in anorganische termen niets meer is dan een hydracide. In tegenstelling tot gasvormige moleculen is het zuurkarakter ervan groter.
Maar of het nu gasvormig is of opgelost in water, het seleniumatoom behoudt dezelfde elektronische kenmerken; zijn valentie is bijvoorbeeld -2, tenzij het een oxidatiereactie ondergaat. Deze valentie van -2 is de reden waarom het seleni wordt genoemdoeros waterstof, aangezien het selenide-anion Se istwee-die reactiever en reducerender is dan Stwee-, sulfide.
Als een systematische nomenclatuur wordt gebruikt, moet het aantal waterstofatomen in de verbinding worden gespecificeerd. Dus de HtweeHet heet: selenide van gafwaterstof.
Selenide of hydride?
Sommige bronnen noemen het een hydride. Als het echt zo was, zou selenium een positieve lading hebben van +2 en waterstof zou een negatieve lading van -1 hebben: SeHtwee (Ik weettwee+, H.-Selenium is een meer elektronegatief atoom dan waterstof, en daarom 'hamstert' het uiteindelijk de hoogste elektronendichtheid in het H-molecuultweeik weet.
Als zodanig kan het bestaan van seleniumhydride echter theoretisch niet worden uitgesloten. In feite, met de aanwezigheid van de anionen H- Het zou de Se-H-Se-bindingen vergemakkelijken, die volgens computationele studies verantwoordelijk zijn voor de vaste structuren die onder enorme druk worden gevormd.
Toepassingen
Metabool
Hoewel het tegenstrijdig lijkt, ondanks de grote giftigheid van HtweeHet wordt in het lichaam geproduceerd via de metabolische route van selenium. Zodra het echter wordt geproduceerd, gebruiken cellen het als tussenproduct bij de synthese van selenoproteïnen, anders wordt het gemethyleerd en uitgescheiden; een van de symptomen hiervan is de smaak van knoflook in de mond.
Industrieel
De HtweeHet wordt voornamelijk gebruikt om seleniumatomen toe te voegen aan vaste structuren, zoals halfgeleidermaterialen; aan organische moleculen, zoals alkenen en nitrilen voor de synthese van organische seleniden; of naar een oplossing om metaalseleniden neer te slaan.
Referenties
- Wikipedia. (2018). Waterstofselenide. Hersteld van: en.wikipedia.org
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Atomistry. (2012). Waterstofselenide, H.tweeIk weet. Hersteld van: selenium.atomistry.com
- Tang Y. & col. (2017). Waterstofselenide (H.tweeSe) Dopantgas voor seleniumimplantatie. 21e internationale conferentie over ionenimplantatietechnologie (IIT). Tainan, Taiwan.
- Chemische formulering. (2018). Waterstofselenide. Hersteld van: Formulacionquimica.com
- PubChem. (2019). Waterstofselenide. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Zhang, S.. et al. (2015). Fasendiagram en hoge temperatuur supergeleiding van gecomprimeerde seleniumhydriden. Sci Rep. 5, 15433; doi: 10.1038 / srep15433.
- Acids.Info. (2019). Seleenzuur: eigenschappen en toepassingen van dit hydracide. Hersteld van: acidos.info/selenhidrico


Niemand heeft nog op dit artikel gereageerd.