
Calciumperoxide (CaO2) eigenschappen, risico's en toepassingen
De calciumperoxide, ook bekend als calciumdioxide, het is een chemische verbinding met de formule CaOtwee. Het treedt op met de interactie van het oplossen van een zout of calciumhydroxide en natriumperoxide met daaropvolgende kristallisatie.
Calciumperoxide wordt geproduceerd door precipitatie van de octahydraatverbinding uit een waterige oplossing, gevolgd door dehydratie bij temperaturen boven 100 ° C..
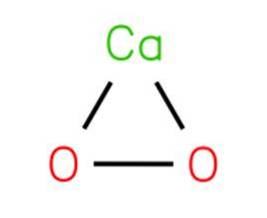
Calciumperoxide wordt afgebroken om zuurstof vrij te maken wanneer het in contact komt met gehydrateerd materiaal. CaOtwee is een van de meest temperatuurstabiele anorganische peroxiden en ontleedt langzaam in vochtige lucht.
Een 1: 100 waterige suspensie heeft een pH van ongeveer 12. Behalve zijn stabiele zuurstofafgevende capaciteit, CaOtwee Het heeft vergelijkbare functies als andere peroxiden: bleken, desinfecteren en ontgeuren. Verder is het opmerkelijk dat CaOtwee het is respectvol met het milieu vanwege zijn eigenschappen. (Kingsfield Inc, 2011).
Artikel index
- 1 Fysische en chemische eigenschappen van calciumperoxide
- 2 Reactiviteit en gevaren
- 3 toepassingen
- 3.1 Gebruik bij bodemsanering
- 3.2 Andere toepassingen
- 3.3 Herstel van het milieu
- 3.4 Industrieel gebruik
- 4 referenties
Fysische en chemische eigenschappen van calciumperoxide
Calciumperoxide is een wit of geelachtig poeder zonder karakteristiek aroma of smaak (National Center for Biotechnology Information., 2017).

CaOtwee het heeft een molecuulgewicht van 72,0768 g / mol en een dichtheid van 2,91 g / ml. De verbinding heeft een smeltpunt van 200 ° C en ontleedt boven 355 ° C. Het is enigszins oplosbaar in water en vormt waterstofperoxide. Het heeft een pKa van 12,5 (Royal Society of Chemistry, 2015).
Calciumperoxide is een explosiegevaar indien gemengd met fijnverdeeld organisch materiaal. De verbinding is op zichzelf niet brandbaar, maar versnelt eerder de verbranding van brandbaar materiaal. Dit komt doordat mengsels van brandbaar materiaal en peroxide kunnen ontbranden door wrijving of contact met vocht..
Reactiviteit en gevaren
Calciumperoxide, hoewel het een relatief stabiele verbinding is in vergelijking met andere peroxiden, wordt geclassificeerd als een explosieve verbinding en een sterk oxidatiemiddel..
Contact met calciumperoxide kan ernstig irriterend zijn en kan de huid en ogen verbranden. Blootstelling kan de ogen, neus en keel irriteren.
Langdurige blootstelling kan de huid beschadigen. Hogere calciumperoxideniveaus kunnen de longen irriteren en hoesten of kortademigheid veroorzaken..
Nog hogere blootstellingen kunnen ertoe leiden dat vocht zich ophoopt in de longen (longoedeem), wat tot de dood leidt (National Library of Medicine, 2015).
In geval van contact met de ogen, moeten de contactlenzen worden gecontroleerd en verwijderd. Spoel daarna de ogen onmiddellijk met veel koud water gedurende tenminste 15 minuten..
In geval van contact met de huid, moet het getroffen gebied onmiddellijk worden gespoeld met veel water gedurende minstens 15 minuten, terwijl de besmette kleding en schoenen worden verwijderd. Bedek geïrriteerde huid met een verzachtend middel. Was kleding en schoenen voordat u ze opnieuw gebruikt. Als het contact ernstig is, was dan met een desinfecterende zeep en bedek de besmette huid met een antibacteriële crème..
Bij inademing moet het slachtoffer naar een koele plaats worden verplaatst. Als de patiënt niet ademt, wordt kunstmatige beademing gegeven.
Als de verbinding wordt ingeslikt, moet u braken opwekken, tenzij dit wordt voorgeschreven door medisch personeel Het is raadzaam om grote hoeveelheden water te drinken om verdunning van de verbinding te bereiken. Strakke kleding, zoals een overhemdkraag, riem of stropdas, moet worden losgemaakt..
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen (Material Safety Data Sheet Calciumperoxide, 2013).
Toepassingen
Gebruik bij bodemsanering
Van alle manieren waarop u calciumperoxide kunt gebruiken, is de toepassing in de landbouw het meest gangbaar. Het feit dat calciumperoxide zuurstof afgeeft in contact met water, betekent dat het kan worden gebruikt als een manier om uitgeputte grond te verjongen..
Normaal gesproken gaan na intensieve landbouw of wanneer de grond onder water staat, voedingsstoffen en zuurstof verloren uit de grond, waardoor deze onvruchtbaar wordt..
In een dergelijk scenario moeten naast andere ingrepen om de bodem weer leefbaar te maken, verschillende kunstmeststoffen worden gebruikt om mineralen en nutriënten aan de bodem toe te voegen. Calciumperoxide is essentieel voor dit proces, omdat het wordt gebruikt om het zuurstofgehalte van de bodem te verhogen.
Andere gebruiken
Doordat calciumperoxide in combinatie met zuren waterstofperoxide kan afgeven, kan het als bleekmiddel worden gebruikt..
Het wordt op deze manier veel gebruikt in veel papierindustrieën. De productie van waterstofperoxide door deze verbinding maakt het ook nuttig bij het ontgeuren en bleken van haarproducten en textiel..
Calciumperoxide heeft ook een plaats in de gezondheidszorg, omdat het als antisepticum kan worden gebruikt..
Calciumperoxide wordt bij het bakken gebruikt als verwerkingshulpmiddel bij het mengen van brooddeeg. De verbinding valt uiteen in zuurstof zodra deze in contact komt met water. Dit oxideert en versterkt de disulfide- en niet-disulfideverknopingen in gluten..
Herstel van het milieu
Het feit dat calciumperoxide kan dienen als een bron van zuurstof, betekent dat het nuttig is in veel ecologische omgevingen..
Er zijn bijvoorbeeld veel watermassa's zoals meren en vijvers die niet meer levensvatbaar zijn geworden door vervuiling en andere gerelateerde factoren..
In een dergelijk scenario kan calciumperoxide ook worden gebruikt om deze watermassa's te verjongen. De zuurstof die vrijkomt bij de reactie tussen het water en de verbinding herstelt het zuurstofgehalte van het water.
Industrieel gebruik
De rol van calciumperoxide bij de productie van kunststoffen is cruciaal voor de katalyse- en verknopingsprocessen van de verschillende verbindingen die worden gebruikt bij de polymerisatie van kunststoffen om ze hard te maken. Calciumperoxide wordt ook gebruikt als initiator van deze processen (Chuangjia Chemical Co, 2011).
Referenties
- CALCIUM PEROXIDE. (2016). Opgehaald van cameochemicals.noaa.gov.
- Calciumperoxide. (S.F.). Opgehaald van bakerpedia.com.
- Chuangjia Chemical Co. (2011). Calciumperoxide. Opgehaald van chinacjchem.com.
- EMBL-EBI. (2014, 28 juli). calciumperoxide. Hersteld van ebi.ac.uk.
- Kingsfield Inc. (2011). Calciumperoxide-CALGRO ™. Opgehaald van kingsfieldinc.
- Veiligheidsinformatieblad Calciumperoxide. (2013, 21 mei). Opgehaald van sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie ... (2017, 11 maart). PubChem samengestelde database; CID = 14779. Opgehaald van PubChem.
- Nationale bibliotheek van geneeskunde. (2015, 19 oktober). CALCIUM PEROXIDE. Hersteld detoxnet.
- Royal Society of Chemistry. (2015). Calciumdioxidaandiide. Opgehaald van chemspider.com.


Niemand heeft nog op dit artikel gereageerd.