
Mangaanchloride-eigenschappen, structuur, gebruik, risico's

De mangaanchloride is een anorganisch zout waarvan de chemische formule MnCl istwee. Het bestaat uit Mn-ionentwee+ en Cl- in een verhouding van 1: 2; voor elk Mn-kationtwee+ er zijn twee keer zoveel anionen Cl-.
Dit zout kan verschillende hydraten vormen: MnCltwee2HtweeO, (dihydraat), MnCltwee4HtweeO (tetrahydraat) en MnCltwee6HtweeO (hexahydraat) De meest voorkomende vorm van zout is tetrahydraat.

De fysische eigenschappen van mangaanchloride, zoals dichtheid, smeltpunt en oplosbaarheid in water, worden beïnvloed door de mate van hydratatie. Het smeltpunt van de watervrije vorm is bijvoorbeeld veel hoger dan dat van de tetrahydraatvorm..
De kleur van mangaanchloride is bleekroze (bovenste afbeelding). Bleekheid is kenmerkend voor overgangsmetaalzouten. Mangaanchloride is een zwak Lewis-zuur.
Het mineraal dat bekend staat als escacquita is de van nature watervrije vorm van mangaan (II) chloride; zoals de kempita.
Mangaan (II) chloride wordt gebruikt als legeringsmiddel; katalysator in chloreringsreacties, enz..
Artikel index
- 1 Fysieke eigenschappen
- 1.1 Fysiek uiterlijk
- 1,2 molaire massa
- 1.3 Smeltpunten
- 1.4 Kookpunt
- 1.5 Dichtheden
- 1.6 Oplosbaarheid in water
- 1.7 Oplosbaarheid in organische oplosmiddelen
- 1.8 Ontleding
- 1,9 pH
- 1.10 Stabiliteit
- 2 Structuur van mangaanchloride
- 2.1 Dihydraat
- 2.2 Watervrij
- 3 Nomenclatuur
- 4 toepassingen
- 4.1 Laboratorium
- 4.2 Industrie
- 4.3 Meststof en diervoeder
- 5 Risico's
- 6 referenties
Fysieke eigenschappen
Fysiek uiterlijk
- Watervrije vorm: roze kubische kristallen.
- Tetrahydraatvorm: licht vervloeiende roodachtige monokliene kristallen.
Molaire massa
- Watervrij: 125,838 g / mol.
- Dihydraat: 161,874 g / mol.
- Tetrahydraat: 197,91 g / mol.
Smeltpunten
- Watervrij: 654 ºC.
- Dihydraat: 135 ºC.
- Tetrahydraat: 58 ºC.
Kookpunt
Watervrije vorm: 1.190 ºC.
Dichtheden
- Watervrij: 2,977 g / cm3.
- Dihydraat: 2,27 g / cm3.
- Tetrahydraat: 2,01 g / cm3.
Oplosbaarheid in water
Watervrije vorm: 63,4 g / 100 ml bij 0 ° C; 73,9 g / 100 ml bij 20 ° C; 88,5 g / 100 ml bij 40 ° C; en 123,8 g / 100 ml bij 100 ° C.
Oplosbaarheid in organische oplosmiddelen
Oplosbaar in pyridine en ethanol, onoplosbaar in ether.
Ontleding
Tenzij de juiste voorzorgsmaatregelen worden genomen, kan dehydratatie van de gehydrateerde vormen tot de watervrije vorm leiden tot hydrolytische dehydratie, met de productie van waterstofchloride en mangaanoxychloride..
pH
Een 0,2 M oplossing van mangaanchloridetetrahydraat in waterige oplossing heeft een pH van 5,5.
Stabiliteit
Het is stabiel, maar gevoelig voor vocht en onverenigbaar met sterke zuren, reactieve metalen en waterstofperoxide.
Structuur van mangaanchloride

Beginnend met het tetrahydraatzout, met opvallende roze kristallen, moet het bestaan uit coördinatiecomplexen (bovenste afbeelding). In hen, het metalen centrum van Mntwee+ is omgeven door een octaëder die wordt gedefinieerd door vier moleculen van H.tweeO en twee Cl-anionen-.
Merk op dat de Cl-liganden- zich in cis-posities bevinden; ze zijn allemaal equivalent in de rechthoekige basis van de octaëder, en het maakt niet uit of de Cl wordt "verplaatst"- naar een van de andere drie posities. Een ander mogelijk isomeer voor dit gecoördineerde molecuul is waarin beide Cl- zijn in transposities; dat wil zeggen, in verschillende extremen (de ene boven en de andere hieronder).
De vier watermoleculen met hun waterstofbruggen maken het mogelijk dat twee of meer octaëders worden verbonden door dipool-dipoolkrachten. Deze bruggen zijn sterk directioneel en voegen de elektrostatische interacties tussen de Mntwee+ en Cl-, een geordende structuur vaststellen die kenmerkend is voor een kristal.
De roze kleur van MnCltwee4HtweeOf is het te wijten aan de elektronische overgangen van de Mntwee+ en zijn configuratie d5. Evenzo wijzigen de verstoringen veroorzaakt door de nabijheid van watermoleculen en chloriden de hoeveelheid energie die nodig is om door dergelijke elektronen te worden geabsorbeerd.5 om hogere energieniveaus te reizen.
Dihydraat
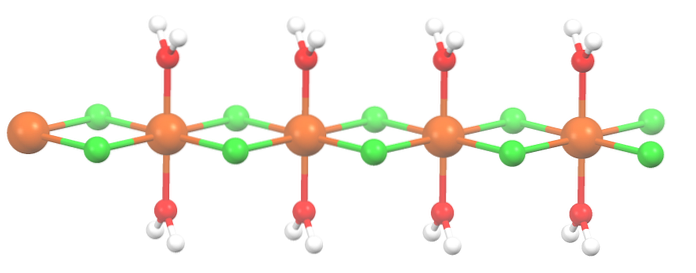
Het zout is gedehydrateerd en de formule is nu MnCltwee2HtweeO. Hoe zit het met de octaëder hierboven? Niets, behalve dat de twee moleculen van HtweeOf die afgevallen zijn, worden vervangen door twee Cl-.
In eerste instantie zou je de verkeerde indruk kunnen wekken dat er vier Cl zijn- voor elke Mntwee+echter, de helft van de octaëder (axiaal) is eigenlijk de herhalende eenheid van het kristal.
Het is dus waar dat er een Mntwee+ gecoördineerd met twee Cl- en twee watermoleculen in transposities. Maar om deze eenheid te laten communiceren met een andere, heeft het twee Cl-bruggen nodig, waardoor de coördinatie-octaëder voor mangaan kan worden voltooid..
Naast Cl-bruggen werken ook watermoleculen samen met hun waterstofbruggen zodat deze MnCl-keten ontstaattwee2HtweeOf ontwapenen niet.
Watervrij
Ten slotte heeft het magnesiumchloride al het water in zijn kristallen verloren; we hebben nu het watervrije zout, MnCltwee. Zonder de watermoleculen verliezen de kristallen merkbaar de intensiteit van hun roze kleur. De octaëder blijft, wat betreft hydraten, onveranderd door de aard van mangaan.
Zonder watermoleculen, Mntwee+ uiteinden omgeven door een octaëder die alleen uit Cl-. Deze coördinatiebinding is zowel covalent als ionisch van aard; om deze reden verwijst het meestal naar de structuur van MnCltwee als een polymeer kristal. Daarin zijn er afwisselende lagen van Mn en Cl.
Nomenclatuur
Mangaan heeft veel mogelijke oxidatietoestanden. Daarom is de traditionele nomenclatuur voor MnCltwee het is niet opgehelderd.
Aan de andere kant komt mangaanchloride overeen met de bekendere naam, waaraan de '(II)' moet worden toegevoegd om het overeen te laten komen met de stamnomenclatuur: mangaan (II) chloride. En evenzo is er de systematische nomenclatuur: mangaandichloride.
Toepassingen
Laboratorium
Mangaanchloride dient als katalysator voor de chlorering van organische verbindingen.
Industrie
Mangaanchloride wordt gebruikt als grondstof voor de vervaardiging van antiknockers voor benzine; lasmateriaal voor non-ferrometalen; tussenpersoon bij de vervaardiging van pigmenten; en lijnolie droger.
Het wordt in de textielindustrie gebruikt om te bedrukken en te verven; bij de productie van verschillende mangaanzouten, waaronder methylcyclopentadienylmangaan-tricarbonyl gebruikt als baksteenkleurstof; en bij de productie van droge elektrische cellen.
Mangaanchloride wordt gebruikt als legeringsmiddel en wordt toegevoegd aan gesmolten magnesium om mangaan-magnesiumlegeringen te produceren; als tussenproduct bij de bereiding van droogmiddelen voor verf en vernis; en als onderdeel van ontsmettingsmiddelen.
Het wordt ook gebruikt bij de zuivering van magnesium.
Meststof en diervoeder
Mangaanchloride wordt gebruikt als een bron van mangaan, een element dat, hoewel het geen primair voedingselement is voor planten zoals stikstof, fosfor en kalium, wordt gebruikt in tal van biochemische reacties die kenmerkend zijn voor deze levende wezens..
Evenzo wordt het toegevoegd aan het voer van fokdieren om mangaan te leveren, een essentieel sporenelement voor de groei van dieren..
Mangaanchloride is een voedingscomponent die mangaan levert, een element dat betrokken is bij veel processen die nodig zijn voor het leven, waaronder: synthese van vetzuren en geslachtshormonen; assimilatie van vitamine E; kraakbeenproductie; enz.
Risico's
Het kan bij contact met de huid roodheid, irritatie en dermatitis veroorzaken. Mangaanchloride veroorzaakt rode, pijnlijke en tranende ogen.
Bij inademing veroorzaakt zout hoesten, keelpijn en kortademigheid. Aan de andere kant kan inslikken braken, misselijkheid en diarree veroorzaken..
Chronische overmatige inademing van dit zout kan leiden tot longontsteking en daaropvolgende reactieve luchtwegaandoeningen..
De overmatige inname ervan kan psychische stoornissen, uitdroging, hypotensie, lever- en nierfalen, falen van het multiorganstelsel en de dood veroorzaken..
Neurotoxiciteit is de eerste manifestatie van de ongewenste werking van mangaan en kan hoofdpijn, duizeligheid, geheugenverlies, hyperreflexie en milde tremor veroorzaken..
Ernstige toxiciteit manifesteert zich door symptomen en tekenen die lijken op die bij de ziekte van Parkinson.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Mangaan (II) chloride. Hersteld van: en.wikipedia.org
- Sky Spring Nanomaterialen. (2016). Mangaanchloride poeder. Hersteld van: ssnano.com
- Chemisch boek. (2017). Mangaanchloride. Hersteld van: chemicalbook.com
- Toxicologie Datanetwerk. (s.f.). Mangaanchloride. Toxnet. Hersteld van: toxnet.nlm.nih.gov
- Gérard Cahiez. (2001). Mangaan (II) Chloride. doi.org/10.1002/047084289X.rm020
- Nationaal centrum voor informatie over biotechnologie. (2019). Mangaandichloride. PubChem-database. CID = 24480. Hersteld van: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Mineralen: mangaan. Hersteld van: webconsultas.com



Niemand heeft nog op dit artikel gereageerd.