
Natriumchloride (NaCl) structuur, eigenschappen, gebruik
De natriumchloride, Ook wel keukenzout of keukenzout genoemd, het is een binair anorganisch zout van het alkalimetaalnatrium en het halogeenchloor. Het is het grootste bestanddeel van eetbaar zout en de minerale vorm staat bekend als haliet. De molecuulformule is NaCl, en het beschrijft de stoichiometrische verhouding van zijn ionen (Na+ Cl-) en niet die van een afzonderlijk molecuul (Na-Cl)
Natriumchloride is een witte kristallijne vaste stof die wordt gevormd door de combinatie van natrium, een zilverachtig wit metaal, dat heftig reageert met water, en het element chloor, een giftig, bijtend en bleekgroen gas..

Een deel van de NaCl-kristallen wordt weergegeven in de bovenste afbeelding. Hoe is het mogelijk dat twee elementen zo gevaarlijk zijn als Na en Cltwee, kan er een eetbaar zout gevormd worden? Ten eerste is de chemische vergelijking voor zijn vorming:
2Na (s) + Cltwee(g) => 2NaCl (s)
Het antwoord ligt in de aard van de binding in NaCl. Omdat het ionisch is, hebben de eigenschappen van Na+ en Cl- zijn diagonaal verschillend van hun neutrale atomen.
Natrium is een essentieel element, maar in zijn ionische vorm. Dan een+ is het belangrijkste extracellulaire kation met een concentratie van ongeveer 140 mEq / l, en samen met zijn begeleidende anionen, Cl- en de HCO3- (bicarbonaat), zijn voornamelijk verantwoordelijk voor de waarde van osmolariteit en extracellulair volume.
Bovendien is de Na+ het is verantwoordelijk voor het genereren en geleiden van de zenuwimpuls in de neuronale axonen, evenals voor het initiëren van spiercontractie.
NaCl wordt al sinds de oudheid gebruikt om voedsel op smaak te brengen en vlees te conserveren, vanwege het vermogen om bacteriën te doden en bederf te voorkomen.
Het is ook nodig voor de productie van natriumhydroxide (NaOH) en moleculair chloor (Cltwee), NaCl laten reageren met water onder hydrolyse:
2HtweeO (l) + 2 NaCl (s) => 2NaOH (aq) + Cltwee(g) + Htwee(g)
In de kathode (-) accumuleren de Htwee (g) en NaOH. Ondertussen hoopt de Cl zich op in de anode (+)twee (g). Natriumhydroxide wordt gebruikt bij de vervaardiging van zeep en chloor bij de vervaardiging van PVC-plastic.
Artikel index
- 1 Structuur van natriumchloride
- 1.1 Eenheidscel
- 2 Eigenschappen
- 2.1 Moleculaire formule
- 2.2 Molecuulgewicht
- 2.3 Fysieke beschrijving
- 2.4 Kleur
- 2.5 Smaak
- 2.6 Kookpunt
- 2.7 Smeltpunt
- 2.8 Oplosbaarheid in water
- 2.9 Oplosbaarheid in organische oplosmiddelen
- 2.10 Dichtheid
- 2.11 Dampspanning
- 2.12 Stabiliteit
- 2.13 Ontleding
- 2.14 Viscositeit
- 2.15 Corrosie
- 2,16 pH
- 3 toepassingen
- 3.1 In eten
- 3.2 Industrieel gebruik
- 3.3 Thuis
- 3.4 Andere toepassingen
- 3.5 Therapeutische toepassingen
- 4 Toxiciteit
- 4.1 Inslikken
- 4.2 Irritatie en lichamelijk contact
- 5 referenties
Structuur van natriumchloride
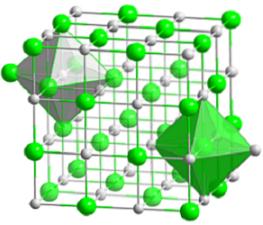
De bovenste afbeelding stelt de compacte kubusvormige structuur van natriumchloride voor. De volumineuze groene bollen komen overeen met de Cl-anionen-, terwijl de witte, naar de Na kationen+. Merk op hoe het NaCl-kristal bestaat uit een netwerk van ionen gerangschikt door hun elektrostatische interacties in een verhouding van 1: 1..
Hoewel in de afbeelding staven worden weergegeven, zijn de bindingen niet covalent maar ionisch. Het gebruik van staven is handig bij het weergeven van de coördinatiegeometrie rond een ion. In het geval van NaCl bijvoorbeeld elke Na+ is omgeven door zes Cl- (witte octaëder), en elke Cl- van zes Na+ (groene octaëder).
Daarom heeft het een coördinatie (6,6) waarvan de nummers aangeven hoeveel buren elk ion omringen. Het nummer aan de rechterkant geeft de buren van de Na aan+, terwijl die aan de linkerkant, die van de Cl-.
Andere weergaven laten het gebruik van staven weg om de octaëdrische gaten in de structuur te markeren, die het gevolg zijn van de interstitiële ruimte tussen zes Cl-anionen.- (of Na kationen+) verpakt. Deze opstelling wordt waargenomen in andere mono (MX) of polyatomische anorganische zouten en wordt het edelsteenzout genoemd.
Eenheid cel
De eenheidscel van steenzout is kubusvormig, maar welke blokjes vertegenwoordigen het precies in de bovenstaande afbeelding? De octaëders geven het antwoord. Beiden beslaan een totale cel die uit vier kleine blokjes bestaat.
Deze kubussen hebben delen van de ionen op hun hoekpunten, randen en vlakken. Als ik goed kijk, een Na-ion+ het bevindt zich in het midden en twaalf aan de randen. Een ion op een rand kan worden gedeeld door vier kubussen. Er zijn dus 4 Na-ionen+ (12 × 1/4 + 1 = 4).
Voor Cl-ionen-, acht bevinden zich op de hoekpunten en zes op de randen. Omdat de ionen die op de hoekpunten zijn gepositioneerd de ruimte delen met acht andere kubussen en aan de randen met zes, hebben we 4 Cl-ionen- (8 × 1/8 + 6 × 1/2 = 4).
Het bovenstaande resultaat wordt als volgt geïnterpreteerd: in de eenheidscel van NaCl bevinden zich vier Na-kationen+ en vier Cl-anionen-verhouding die overeenkomt met de chemische formule (a Na+ voor elke Cl-.
Eigendommen
Moleculaire formule
NaCl.
Molecuulgewicht
58,44 g / mol.
Fysieke beschrijving
Een kristallijne vaste stof.
Kleur
Transparante kleurloze kristallen of wit kristallijn poeder.
Smaak
Zout.
Kookpunt
2,575ºF tot 760 mmHg.
1.465 ºC.
Smeltpunt
1.474 ºF (800,7 ºC).
Zowel het kookpunt als het smeltpunt reflecteren de warmte die nodig is om de kristallijne rooster-energie te overwinnen. Daarom bevestigen deze metingen het ionische karakter van NaCl..
Oplosbaarheid in water
Groter dan of gelijk aan 100 mg / ml bij 68 ºF.
36,0 g / 100 ml bij 25 ° C.
Het is in feite een hygroscopisch zout, dat vocht uit de omgeving vasthoudt.
Oplosbaarheid in organische oplosmiddelen
0,065 g / 100 ml ethanol bij 25 ° C; 10 g / 100 g glycerol bij 25 ° C; 2,15 g / 100 ml vloeibare ammoniak bij 40 ° C; 1,4 g / 100 ml methanol bij 25 ° C; 7,15 g / 100 g ethyleenglycol bij 25 ° C en 5,21 g / 100 g mierenzuur bij 25 ° C.
Dichtheid
2,165 g / cm3 bij 77 ºC.
Dampdruk
1 mmHg bij 1.589ºF.
Stabiliteit
Stabiel onder de aanbevolen opslagomstandigheden.
Ontleding
Bij verhitting tot hoge temperaturen ontleedt het, waarbij zoutzuur en dinatriumoxidedampen vrijkomen..
Viscositeit
Viscositeit van verzadigde oplossingen 1,93 mPa-s.
Corrosie
Het is corrosief voor veel metalen.
pH
6,7 tot 7,3 in waterige oplossing.
Toepassingen
In eten
-Natriumchloride wordt al sinds de oudheid gebruikt om de smaak van voedsel te verbeteren en te bewaren. Het zouten van vlees is een manier om het te beschermen tegen bacteriële werking, omdat het de afbraak van eiwitten vertraagt.
-Aan de andere kant verhoogt zout de osmolariteit rond het vlees, waardoor het water van de bacteriën wordt opgenomen door osmose, waardoor het wordt geëlimineerd.
Industrieel gebruik
Voedselindustrie
-In de voedingsindustrie wordt zout gebruikt als smaakversterker, additief voor fermentatiecontrole, textuurcontrolemiddel en kleurontwikkelaar. Er wordt bijvoorbeeld zout toegevoegd om de kleur in spek, ham en andere vleesproducten te laten uitkomen..
-Zout dient als bindmiddel bij het maken van worsten. Draagt bij aan de vorming van een bindmiddelgel samengesteld uit vlees, vet en vocht.
-Bij de verwerking van meel voor het maken van brood wordt tijdens het bakken zout toegevoegd om de rijsnelheid van brooddeeg te regelen. Het wordt ook gebruikt om gluten te versterken en als smaakversterker, evenals als vulling in gebakken goederen.
-Het wordt gebruikt bij de vervaardiging van ontbijtgranen, gemengde of bereide meelsoorten, frites, honden- en kattenvoer, enz..
Synthese van chemicaliën
-Natriumchloride wordt gebruikt als grondstof bij de productie van natriumhydroxide en chloor, die op hun beurt nuttig zijn in veel chemische industrieën.
-Zout wordt gebruikt bij de verwerking van verschillende metalen, bijvoorbeeld aluminium, koper, staal en vanadium. Het wordt ook gebruikt om natriumchloraat te maken, dat later wordt gebruikt bij de synthese van chloordioxide, een bleekmiddel op zuurstofbasis. Chloordioxide is minder schadelijk voor het milieu dan andere bleekmiddelen.
In de leerindustrie
-Het zout wordt gebruikt om de bacteriële werking in de huid te remmen en om te helpen bij de rehydratatie ervan.
In de textielindustrie
-Zout wordt gebruikt als bijtmiddel bij het verven van stoffen. Het wordt gebruikt als pekelspoeling om organische verontreinigingen te verwijderen en om een positieve lading op het oppervlak van stoffen te creëren waardoor negatief geladen kleurstoffen kunnen worden gebonden.
In de olie-industrie
-Bij olie- en gasexploratie is zout een belangrijk onderdeel van boorvloeistoffen. Het wordt gebruikt om uitvlokking te maken en de dichtheid van boorvloeistoffen te verhogen, waardoor de hoge gasdrukken in de te bereiken putten kunnen worden overwonnen. Bovendien handhaaft het zout de verzadiging van de boorvloeistof.
-Zout helpt de grond te verdichten waarop wegen zijn aangelegd. Vermindert ondergrondse verplaatsing veroorzaakt door veranderingen in vochtigheid en autoverkeer.
In het huis
Zout is gebruikt door te wrijven in het reinigen van oppervlakken, potten en pannen. Ook ter voorkoming van schimmel en als vlekverwijderaar. Het wordt ook in veel merken shampoo en tandpasta gebruikt..
Andere gebruiken
Op de wegen
-In afwachting van sneeuwval zijn wegen bedekt met pekel, waardoor ijs niet aan het wegdek kan hechten. Voor het ontdooien wordt een mengsel van pekel en zout gebruikt, en soms worden andere chemische componenten zoals magnesium of calciumchloride toegevoegd. Het gebruik van zout en pekel is niet effectief bij temperaturen onder de -10 ºC.
Door zout toe te voegen neemt het cryoscopische punt af, een colligatieve eigenschap van de oplossingen, waardoor de vorming van ijs op een bepaalde manier wordt belemmerd..
-Vanwege de hygroscopische toestand wordt zout als goedkoop droogmiddel gebruikt.
In harsen die worden gebruikt om water te verzachten
Hard water bevat calcium- en magnesiumionen die de werking van zeep belemmeren en afzettingen van alkalische stoffen op verschillende apparatuur en leidingen veroorzaken. Bij waterontharding worden ionenuitwisselingsharsen gebruikt. Zout wordt gebruikt bij de bereiding en regeneratie van harsen.
In brandblussers
Natriumchloride wordt gebruikt in brandblussers om branden te bestrijden waarin brandbare metalen aanwezig zijn, zoals magnesium-, kalium-, natrium- en NK-legeringen..
Zout werkt als een koellichaam en vormt ook een korst die de zuurstoftoegang tot het vuur beperkt..
In de glazen
Natriumchloridekristallen worden gebruikt in optische componenten zoals vensters en prisma's, vooral voor infrarood licht. Omdat het zout echter erg hygroscopisch is, ontstaat er een soort rijp die de lenzen bedekt. Om deze reden zijn lenzen van natriumchloride vervangen door lenzen van zinkselenide (ZnSe)..
Therapeutische toepassingen
Maak het gebrek aan zouten in het lichaam goed
-Als er een lichamelijke uitputting van Na is+, moet worden vervangen om extracellulaire osmolariteit, zenuwgeleiding en spiercontractie te behouden.
-NaCl wordt gebruikt bij de behandeling en preventie van natrium- en chloortekort als gevolg van overmatig zweten tijdens blootstelling aan hoge temperaturen. Het wordt ook gebruikt bij een overmatige diurese of een overmatige beperking van de inname van zoutoplossing.
-Parenterale toediening van een 045% NaCl-oplossing wordt gebruikt bij de behandeling van hyperosmolaire diabetes. Het vervult een rehydraterende functie en dient om de status van de nierfunctie te beoordelen.
-Injecties van hypertone oplossingen, met een NaCl-concentratie van meer dan 0,9% w / v,
-Ze worden gebruikt als er een ernstige Na-uitputting is+, zijnde een herstel van het essentiële ion. Deze hyponatriëmie kan het gevolg zijn van een behandeling met vrije elektrolyten of met een concentratie Na+.
Hyponatriëmie kan ook worden veroorzaakt door overmatige waterinname, die niet onder controle kan worden gehouden door een onvoldoende nierfunctie..
Bij onconventionele behandelingen en toepassingen
-NaCl-inhalatieoplossingen worden gebruikt om de medicijnen die tijdens het vernevelingsproces worden gebruikt, te verdunnen. Het wordt ook gebruikt voor tracheale spoeling en irrigatie. 0,9% zoutoplossing gebruikt in neussprays.
-20% NaCl-oplossingen worden gebruikt voor intra-amniotische trans-abdominale installatie, waardoor een late abortus tijdens het tweede trimester van de zwangerschap wordt geïnduceerd..
-Natriumchloride kan worden gebruikt als lokaal antisepticum. Dankzij zijn osmotische capaciteit is het in staat om een breed spectrum van virussen en bacteriën in een niet-aangespoorde toestand te dehydrateren; daarom wordt het gebruikt als een pijnlijk antisepticum om wonden te desinfecteren.
Toxiciteit
Inslikken
Het heeft alleen een schadelijk effect op de gezondheid als de inname hoog en langdurig is. Onder deze omstandigheden zou hypernatriëmie optreden met als gevolg een toename van het extracellulaire volume dat zou leiden tot arteriële hypertensie..
Irritatie en lichamelijk contact
Het heeft alleen een toxisch effect als de inademing erg hoog is. Overmatig contact met de huid kan een droge huid veroorzaken. Ten slotte veroorzaakt het een tijdelijke irritatie bij contact met de ogen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde editie., Pp. 84, 90, 93, 263). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Chemie. (8e ed.). CENGAGE Leren, p 482-483.
- Natriumchloride. (2018). Natriumchloride: voordelen, toepassingen, eigenschappen, risico's. Ontleend aan: sodium chloride.org
- PubChem. (2018). Natriumchloride. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Natriumchloride. Genomen uit: en.wikipedia.org
- Amerikaanse elementen. (2018). Natriumchloride. Genomen uit: americanelements.com


Niemand heeft nog op dit artikel gereageerd.