
Eigenschappen, toepassingen en voorbeelden van gehalogeneerde derivaten

De gehalogeneerde derivaten zijn al die verbindingen met een halogeenatoom; dat wil zeggen, elk van de elementen van groep 17 (F, Cl, Br, I). Deze elementen verschillen van de rest doordat ze meer elektronegatief zijn en een diversiteit aan anorganische en organische halogeniden vormen..
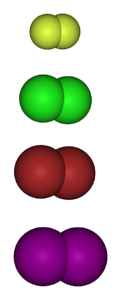
De onderstaande afbeelding toont de gasvormige moleculen van de halogenen. Van boven naar beneden: fluor (F.twee), chloor (Cltwee), broom (Brtwee) en jodium (ItweeElk van deze heeft het vermogen om te reageren met de overgrote meerderheid van de elementen, zelfs tussen soortgenoten van dezelfde groep (interhalogenen).
Zo hebben gehalogeneerde derivaten de formule MX als het een metaalhalogenide is, RX als het alkyl is en ArX als het aromatisch is. De laatste twee vallen in de categorie organische halogeniden. De stabiliteit van deze verbindingen vereist een energie "voordeel" in vergelijking met het oorspronkelijke gasmolecuul.
Over het algemeen vormt fluor stabielere gehalogeneerde derivaten dan jodium. De reden is te wijten aan de verschillen tussen hun atoomstralen (de paarse bollen zijn volumineuzer dan de gele).
Naarmate de atoomstraal toeneemt, is de overlap van de orbitalen tussen het halogeen en het andere atoom slechter en daarom is de binding zwakker..
Artikel index
- 1 Nomenclatuur
- 1.1 Anorganische stoffen
- 1.2 Biologisch
- 2 Eigenschappen
- 2.1 Anorganische halogeniden
- 2.2 Organische halogeniden
- 3 toepassingen
- 4 Aanvullende voorbeelden
- 5 referenties
Nomenclatuur
De juiste manier om deze verbindingen te noemen, hangt af van of ze anorganisch of organisch zijn..
Anorganisch
Metaalhalogeniden bestaan uit een binding, ionisch of covalent, tussen een halogeen X en een metaal M (uit groepen 1 en 2, overgangsmetalen, zware metalen, etc.).
In deze verbindingen hebben alle halogenen een oxidatietoestand van -1. Waarom? Omdat de valentie-instellingen ns zijntweenp5.
Daarom hoeven ze maar één elektron te krijgen om het valentie-octet te voltooien, terwijl metalen oxideren, waardoor ze de elektronen krijgen waarover ze beschikken..
De fluor blijft dus als F-, fluoride; de Cl-, chloride; de BR-, bromide; en de ik-, Ik laatste. MF zou worden genoemd: (metaalnaam) fluoride (n), waarbij n alleen de valentie van het metaal is als het er meer dan één heeft. Voor metalen uit de groepen 1 en 2 is het niet nodig de valentie te noemen.
Voorbeelden
- NaF: natriumfluoride.
- CaCltwee: calciumchloride.
- AgBr: zilverbromide.
- ZnItwee: zinkjodide.
- CuCl: koper (I) chloride.
- CuCltwee: koper (II) chloride.
- TiCl4: titanium (IV) chloride of titaniumtetrachloride.
Waterstof en niet-metalen elementen - zelfs halogenen zelf - kunnen echter ook halogeniden vormen. In deze gevallen wordt de valentie van het niet-metaal aan het einde niet genoemd:
- PCl5: fosforpentachloride.
- BF3: boortrifluoride.
- Ali3: aluminiumtrijodide.
- HBr: waterstofbromide.
- ALS7: jodium heptafluoride.
Biologisch
Ongeacht of het RX of ArX is, halogeen is covalent gebonden aan een koolstofatoom. In deze gevallen worden halogenen met hun naam genoemd, en de rest van de nomenclatuur hangt af van de moleculaire structuur van R of Ar.
Voor het eenvoudigste organische molecuul, methaan (CH4), worden de volgende derivaten verkregen door H te vervangen door Cl:
- CH3Cl: chloormethaan.
- CHtweeCltwee: dichloormethaan.
- CHCl3: trichloormethaan (chloroform).
- CCl4: tetrachloormethaan (koolstof (IV) chloride of koolstoftetrachloride).
Hier bestaat R uit een enkel koolstofatoom. Dus voor andere alifatische ketens (lineair of vertakt) wordt het aantal koolstofatomen waarvan het is gekoppeld aan het halogeen geteld:
CH3CHtweeCHtweeF: 1-fluorpropaan.
Het bovenstaande voorbeeld was dat van een primair alkylhalogenide. In het geval dat de ketting vertakt is, wordt de langste ketting met het halogeen gekozen en begint het tellen, waarbij het kleinst mogelijke aantal overblijft:
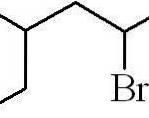
3-methyl-5-broomhexaan
Hetzelfde gebeurt voor andere substituenten. Evenzo wordt voor aromatische halogeniden het halogeen genoemd en vervolgens de rest van de structuur:
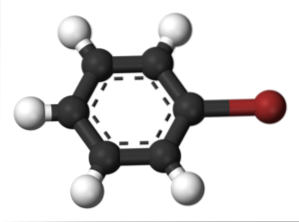
De bovenste afbeelding toont de verbinding die broombenzeen wordt genoemd, waarbij het broomatoom bruin wordt gemarkeerd.
Eigendommen
Anorganische halogeniden
Anorganische halogeniden zijn ionische of moleculaire vaste stoffen, hoewel de eerste meer voorkomen. Afhankelijk van de interacties en ionstralen van MX, zal het oplosbaar zijn in water of andere minder polaire oplosmiddelen.
Niet-metaalhalogeniden (zoals boorhalogeniden) zijn over het algemeen Lewis-zuren, wat betekent dat ze elektronen accepteren om complexen te vormen. Aan de andere kant produceren waterstofhalogeniden (of halogeniden) die zijn opgelost in water zogenaamde hydraciden..
Zijn smelt-, kook- of sublimatiepunten vallen onder de elektrostatische of covalente interacties tussen het metaal of niet-metaal met het halogeen..
Evenzo spelen ionstralen een belangrijke rol bij deze eigenschappen. Als bijvoorbeeld M+ en X- vergelijkbare afmetingen hebben, zullen uw kristallen stabieler zijn.
Organische halogeniden
Ze zijn polair. Waarom? Omdat het verschil in elektronegativiteiten tussen C en halogeen een permanent polair moment in het molecuul creëert. Evenzo neemt dit af naarmate groep 17 afdaalt, van de C-F-binding naar C-I.
Ongeacht de moleculaire structuur van R of Ar, hebben de toenemende aantallen halogenen rechtstreeks invloed op de kookpunten, aangezien ze de molaire massa en de intermoleculaire interacties (RC-X-X-CR) verhogen. De meeste zijn niet mengbaar met water, maar kunnen wel oplossen in organische oplosmiddelen.
Toepassingen
De toepassingen van de gehalogeneerde derivaten zouden hun eigen tekst kunnen behouden. De moleculaire "partners" van halogenen zijn een sleutelfactor, aangezien hun eigenschappen en reactiviteiten het gebruik van het derivaat bepalen..
Zo vallen onder de grote diversiteit aan mogelijke toepassingen de volgende op:
- Moleculaire halogenen worden gebruikt om halogeenlampen te maken, waar ze in contact komen met de gloeiende wolfraamgloeidraad. Het doel van dit mengsel is om het halogeen X te laten reageren met het verdampte wolfraam. Op deze manier wordt de afzetting ervan op het oppervlak van de lamp vermeden, wat een langere levensduur garandeert..
- Fluoridezouten worden gebruikt bij de fluoridering van water en tandpasta's.
- Natrium- en calciumhypochlorieten zijn twee actieve stoffen in commerciële bleekoplossingen (chloor)..
- Hoewel ze de ozonlaag beschadigen, worden chloorfluorkoolwaterstoffen (CFK's) gebruikt in spuitbussen en koelsystemen..
- Vinylchloride (CHtwee= CHCl) is het monomeer van het polyvinylchloride (PVC) polymeer. Aan de andere kant bestaat teflon, dat als antikleefmateriaal wordt gebruikt, uit polymeerketens van tetrafluorethyleen (FtweeC = CFtwee.
- Ze worden gebruikt in analytische chemie en in organische syntheses voor verschillende doeleinden; onder deze, de synthese van medicijnen.
Aanvullende voorbeelden
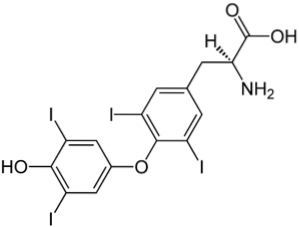
De bovenste afbeelding illustreert het schildklierhormoon, verantwoordelijk voor de productie van warmte en de toename van het algemene metabolisme in het lichaam. Deze verbinding is een voorbeeld van een gehalogeneerd derivaat dat in het menselijk lichaam aanwezig is.
Onder andere gehalogeneerde verbindingen worden de volgende genoemd:
- Dichloordifenyltrichloorethaan (DDT), efficiënt insecticide maar met ernstige gevolgen voor het milieu.
- Tinchloride (SnCltwee), gebruikt als reductiemiddel.
- Chloorethaan of 1-chloorethaan (CH3CHtweeCl), een plaatselijke verdoving die snel werkt door de huid te koelen.
- Dichloorethyleen (ClCH = CClH) en tetrachloorethyleen (CltweeC = CCltwee), gebruikt als oplosmiddelen in de stomerij-industrie.
Referenties
- Dr. Ian Hunt. Basis organische IUPAC-nomenclatuur Haloalkanen / Alkylhalogeniden. Opgehaald op 4 mei 2018, vanuit: chem.ucalgary.ca
- Richard C. Banks. (Augustus 2000). Nomenclatuur van organische halogeniden. Opgehaald op 4 mei 2018, van: chemistry.boisestate.edu
- Advameg, Inc. (2018). Organische halogeenverbindingen. Opgehaald op 4 mei 2018, van: chemistryexplained.com
- Organische halogeenverbindingen. Opgehaald op 4 mei 2018, van: 4college.co.uk
- Dr.Seham Alterary. (2014). Organische halogeenverbindingen. Opgehaald op 4 mei 2018, van: fac.ksu.edu.sa
- Clark J. Physical Properties of Alkyl Halides. Opgehaald op 4 mei 2018, van: chem.libretexts.org
- Dr. Manal K. Rasheed. Organische halogeniden. Opgehaald op 4 mei 2018, van: comed.uobaghdad.edu.iq



Niemand heeft nog op dit artikel gereageerd.