
Eiwit denaturatiefactoren en gevolgen

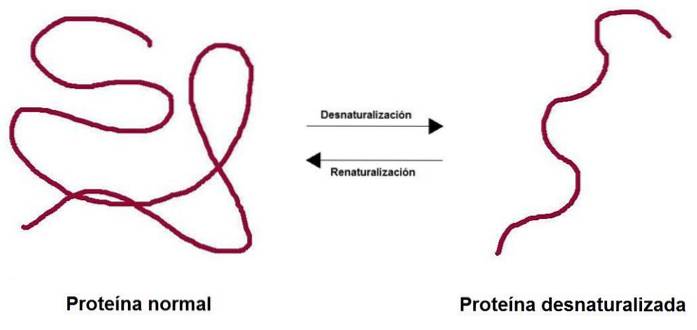
De eiwit denaturatie Het bestaat uit het verlies van de driedimensionale structuur door verschillende omgevingsfactoren, zoals temperatuur, pH of bepaalde chemische middelen. Het verlies van de structuur resulteert in het verlies van de biologische functie die is geassocieerd met dat eiwit, of het nu enzymatisch, structureel of transporter is..
De structuur van het eiwit is erg gevoelig voor veranderingen. De destabilisatie van een enkele essentiële waterstofbinding kan het eiwit denatureren. Evenzo zijn er interacties die niet strikt essentieel zijn om de eiwitfunctie te vervullen, en die, indien gedestabiliseerd, geen effect hebben op de functie..
Artikel index
- 1 Structuur van eiwitten
- 1.1 Primaire structuur
- 1.2 Secundaire structuur
- 1.3 Tertiaire structuur
- 1.4 Quartaire structuur
- 2 factoren die denaturatie veroorzaken
- 2,1 pH
- 2.2 Temperatuur
- 2.3 Chemische stoffen
- 2.4 Reductiemiddelen
- 3 gevolgen
- 3.1 Renaturatie
- 4 Chaperonne-eiwitten
- 5 referenties
Eiwit structuur
Om eiwitdenaturatieprocessen te begrijpen, moeten we weten hoe eiwitten zijn georganiseerd. Deze hebben een primaire, secundaire, tertiaire en quartaire structuur.
Primaire structuur
Het is de opeenvolging van aminozuren waaruit het eiwit bestaat. Aminozuren zijn de fundamentele bouwstenen van deze biomoleculen en er zijn 20 verschillende soorten, elk met specifieke fysische en chemische eigenschappen. Ze binden aan elkaar via een peptidebinding.
Secundaire structuur
In deze structuur begint deze lineaire keten van aminozuren zich door waterstofbruggen te vouwen. Er zijn twee basale secundaire structuren: de α-helix, met een spiraalvorm; en het gevouwen vel β, wanneer twee lineaire kettingen parallel zijn uitgelijnd.
Tertiaire structuur
Betrekt andere soorten krachten die resulteren in specifieke plooien van de driedimensionale vorm.
De R-ketens van de aminozuurresiduen waaruit de eiwitstructuur bestaat, kunnen disulfidebruggen vormen en de hydrofobe delen van de eiwitten klonteren aan de binnenkant samen, terwijl de hydrofiele delen naar het water gericht zijn. De van der Waals-krachten werken als een stabilisator van de beschreven interacties.
Quartaire structuur
Bestaat uit aggregaten van eiwiteenheden.
Wanneer een eiwit wordt gedenatureerd, verliest het zijn quaternaire, tertiaire en secundaire structuur, terwijl het primaire intact blijft. Eiwitten die rijk zijn aan disulfidebindingen (tertiaire structuur) bieden een grotere weerstand tegen denaturatie.
Factoren die denaturatie veroorzaken
Elke factor die de niet-covalente bindingen destabiliseert die verantwoordelijk zijn voor het behoud van de natuurlijke structuur van het eiwit, kan denaturatie ervan veroorzaken. Een van de belangrijkste kunnen we noemen:
pH
Bij zeer extreme pH-waarden, of het nu zuur of basisch is, kan het eiwit zijn driedimensionale configuratie verliezen. Overtollige H-ionen+ en OH- in het midden destabiliseert eiwitinteracties.
Deze verandering in ionenpatroon veroorzaakt denaturatie. Denaturatie door pH kan in sommige gevallen omkeerbaar zijn en in andere onomkeerbaar.
Temperatuur
Thermische denaturatie treedt op bij toenemende temperatuur. In organismen die onder gemiddelde omgevingsomstandigheden leven, beginnen eiwitten te destabiliseren bij temperaturen boven 40 ° C. Het is duidelijk dat de eiwitten van thermofiele organismen deze temperatuurbereiken kunnen weerstaan..
Verhogingen in temperatuur vertalen zich in verhoogde moleculaire bewegingen die waterstofbruggen en andere niet-covalente bindingen beïnvloeden, wat resulteert in het verlies van de tertiaire structuur..
Deze temperatuurstijgingen leiden tot een afname van de reactiesnelheid, als we het over enzymen hebben.
Chemische substanties
Polaire stoffen - zoals ureum - in hoge concentraties beïnvloeden waterstofbruggen. Evenzo kunnen niet-polaire stoffen vergelijkbare gevolgen hebben..
Detergentia kunnen ook de eiwitstructuur destabiliseren; het is echter geen agressief proces en ze zijn meestal omkeerbaar.
Reductiemiddelen
Β-Mercaptoethanol (HOCH2CH2SH) is een chemisch middel dat in het laboratorium vaak wordt gebruikt om eiwitten te denatureren. Het is verantwoordelijk voor het verminderen van disulfidebruggen tussen aminozuurresiduen. Kan de tertiaire of quaternaire structuur van het eiwit destabiliseren.
Een ander reductiemiddel met vergelijkbare functies is dithiothreitol (DTT). Bovendien zijn andere factoren die bijdragen aan het verlies van de natuurlijke structuur in eiwitten zware metalen in hoge concentraties en ultraviolette straling..
Gevolgen
Bij denaturatie verliest het eiwit zijn functie. Eiwitten functioneren optimaal in hun oorspronkelijke staat.
Functieverlies gaat niet altijd gepaard met een denaturatieproces. Het kan zijn dat een kleine verandering in de eiwitstructuur leidt tot functieverlies zonder de gehele driedimensionale structuur te destabiliseren..
Het proces kan al dan niet onomkeerbaar zijn. Als de omstandigheden in het laboratorium worden omgekeerd, kan het eiwit terugkeren naar zijn oorspronkelijke configuratie.
Renaturatie
Een van de beroemdste en meest overtuigende experimenten met renaturatie werd aangetoond in ribonuclease A.
Toen de onderzoekers denaturerende middelen zoals ureum of β-mercaptoethanol toevoegden, werd het eiwit gedenatureerd. Als deze middelen waren verwijderd, keerde het eiwit terug naar zijn oorspronkelijke conformatie en kon het zijn functie uitvoeren met 100% efficiëntie..
Een van de belangrijkste conclusies van dit onderzoek was om experimenteel aan te tonen dat de driedimensionale conformatie van het eiwit wordt bepaald door zijn primaire structuur..
In sommige gevallen is het denaturatieproces volledig onomkeerbaar. Wanneer we bijvoorbeeld een ei koken, passen we warmte toe aan de eiwitten (de belangrijkste is het albumine) waaruit het bestaat, het wit krijgt een stevig en witachtig uiterlijk. Intuïtief kunnen we concluderen dat, zelfs als we het afkoelen, het niet terugkeert naar zijn oorspronkelijke vorm.
In de meeste gevallen gaat het denaturatieproces gepaard met verlies van oplosbaarheid. Het vermindert ook de viscositeit, de diffusiesnelheid en kristalliseert gemakkelijker..
Chaperonne-eiwitten
De proteïne chaperones of chaperonines zijn verantwoordelijk voor het voorkomen van denaturatie van andere proteïnen. Ze onderdrukken ook bepaalde interacties die niet geschikt zijn tussen eiwitten om een correcte vouwing ervan te garanderen..
Wanneer de temperatuur van het medium stijgt, verhogen deze eiwitten hun concentratie en werken ze om de denaturatie van andere eiwitten te voorkomen. Dit is de reden waarom ze ook wel "heat shock-eiwitten" of HSP worden genoemd, naar het Engelse acroniem. (Heat Shock Proteins.
Chaperonines zijn analoog aan een kooi of een vat dat het eiwit van belang binnenin beschermt.
Deze eiwitten die reageren op situaties van cellulaire stress zijn gerapporteerd in verschillende groepen levende organismen en zijn in hoge mate geconserveerd. Er zijn verschillende klassen chaperonines en ze worden geclassificeerd op basis van hun molecuulgewicht..
Referenties
- Campbell, N. A., & Reece, J. B. (2007). biologie. Panamerican Medical Ed..
- Devlin, T. M. (2004). Biochemie: leerboek met klinische toepassingen. Omgekeerd.
- Koolman, J., & Röhm, K. H. (2005). Biochemie: tekst en atlas. Panamerican Medical Ed..
- Melo, V., Ruiz, V. M., & Cuamatzi, O. (2007). Biochemie van metabolische processen. Reverte.
- Pacheco, D., & Leal, D. P. (2004). Medische biochemie. Redactioneel Limusa.
- Pena, A., Arroyo, A., Gómez, A., & Tapia, R. (1988). Biochemie. Redactioneel Limusa.
- Sadava, D., & Purves, W. H. (2009). Life: The Science of Biology. Panamerican Medical Ed..
- Tortora, G. J., Funke, B. R., & Case, C. L. (2007). Inleiding tot microbiologie. Panamerican Medical Ed..
- Voet, D., Voet, J. G., & Pratt, C. W. (2007). Fundamentals of Biochemistry. Panamerican Medical Ed..

Niemand heeft nog op dit artikel gereageerd.