
Dichloormethaanstructuur, eigenschappen, gebruik, toxiciteit
De dichloormethaan, ook bekend als methyleenchloride, het is een organische verbinding waarvan de chemische formule CH istweeCltwee. In het bijzonder is het een alkylhalogenide afgeleid van methaangas. In tegenstelling tot methaan is deze verbinding een kleurloze, polaire vloeistof.
Het werd aanvankelijk in 1839 gesynthetiseerd door de Franse chemicus en natuurkundige Henri Victor Regnault (1810-1878), die erin slaagde het te isoleren van een mengsel van chloor en chloormethaan dat aan zonlicht werd blootgesteld..

Dichloormethaan wordt industrieel geproduceerd door methaan of chloormethaan te behandelen met chloorgas bij verhoogde temperaturen (400-500 ºC). Samen met dichloormethaan worden chloroform en tetrachloorkoolstof geproduceerd in het proces, die worden gescheiden door destillatie..
Dichloormethaan wordt gebruikt als oplosmiddel voor het lassen van kunststoffen en om metalen te ontvetten. Het wordt ook gebruikt bij het cafeïnevrij maken van koffie en thee, evenals een hop-extractor en verdunningsmiddel voor kleuradditieven en inkten voor het markeren van fruit.
Dichloormethaan is een giftige stof die bij inademing irritatie van de neus en keel kan veroorzaken. Leverschade is gemeld bij werknemers die werden blootgesteld aan hoge concentraties dichloormethaan. Bovendien is het een mutagene stof, waarvan wordt vermoed dat het kankerverwekkend is.
Artikel index
- 1 Structuur
- 2 Eigenschappen
- 2.1 Uiterlijk
- 2.2 Molaire massa
- 2.3 Geur
- 2.4 Geurdrempelwaarde
- 2.5 Dichtheid
- 2.6 Smeltpunt
- 2.7 Kookpunt
- 2.8 Oplosbaarheid in water
- 2.9 Oplosbaarheid in andere oplosmiddelen
- 2.10 Verdelingscoëfficiënt octanol / water
- 2.11 Dampspanning
- 2.12 Dampdichtheid
- 2.13 Brekingsindex (πD)
- 2.14 Viscositeit
- 2.15 Vlampunt
- 2.16 Zelfontbrandingstemperatuur
- 2.17 Stabiliteit
- 2.18 Ontleding
- 2.19 Corrosie
- 2.20 Verdampingswarmte
- 2.21 Oppervlaktespanning
- 2.22 Reactiviteit
- 3 toepassingen
- 3.1 Voedselverwerking
- 3.2 Farmaceutische industrie
- 3.3 Fotografie
- 3.4 Elektronica-industrie
- 3.5 Schilderijen
- 3.6 Vervoer
- 3.7 Andere toepassingen
- 4 Toxiciteit
- 4.1 Acute effecten
- 4.2 Chronische effecten
- 5 referenties
Structuur
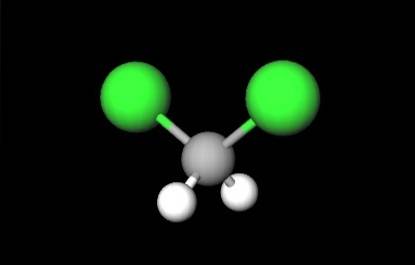
De eerste afbeelding toonde de structuurformule van CHtweeCltwee, waarin hun covalente bindingen C-H en C-Cl opvallen. Daarboven heeft het ook zijn structuur weergegeven door een model van bollen en balken. Merk met het blote oog op dat de C-H-bindingen (witte bollen) kort zijn, terwijl de C-Cl-bindingen (groene bollen) lang zijn.
De geometrie van de CHtweeCltwee het is tetraëdrisch; maar vervormd door de omvangrijkere chlooratomen. Het ene uiteinde van de tetraëder wordt bepaald door de twee chlooratomen, elektronegatiever dan die van waterstof en koolstof. Vandaar in het CH-molecuultweeCltwee er wordt een permanent dipoolmoment vastgesteld (1.6D).
Hierdoor kunnen de dichloormethaanmoleculen met elkaar interageren via dipool-dipoolkrachten. Evenzo zijn deze intermoleculaire interacties verantwoordelijk voor het feit dat deze verbinding ondanks zijn lage moleculaire massa als een vloeistof bestaat; een vloeistof die echter vrij vluchtig is.
Eigendommen
Uiterlijk
Kleurloze vloeistof.
Molaire massa
84,93 g / mol.
Geur
Zoet, vergelijkbaar met chloroform.
Geurdrempel
205-307 ppm.
Dichtheid
1,3266 g / cm3 (20 ºC).
Smeltpunt
- 97,6 ºC.
Kookpunt
39,6 ºC.
Oplosbaarheid in water
25,6 g / l bij 15 ° C en 5,2 g / l bij 60 ° C.
Dichloormethaan is nauwelijks oplosbaar in water. Terwijl beide moleculen, CHtweeCltwee en HtweeOf ze zijn polair, hun interacties zijn inefficiënt, mogelijk vanwege de afstoting tussen de chloor- en zuurstofatomen.
Oplosbaarheid in andere oplosmiddelen
Mengbaar met ethylacetaat, alcohol, hexaan, benzeen, tetrachloorkoolstof, diethylether, chloroform en dimethylformamide.
Verdelingscoëfficiënt octanol / water
Log P = 1,19.
Dampdruk
57,3 kPa (25 ° C). Deze druk komt overeen met ongeveer 5,66 atm, wat een hoge dampdruk weergeeft..
Dampdichtheid
2,93 met betrekking tot lucht genomen als 1.
Brekingsindex (πD)
1.4244 (20 ºC).
Viscositeit
0,413 cP (25 ° C).
ontstekingspunt
Dichloormethaan is niet brandbaar, maar vormt bij vermenging met lucht brandbare dampen boven 100ºC..
Zelfontbranding temperatuur
556 ºC.
Stabiliteit
Het is stabiel bij omgevingstemperatuur in afwezigheid van vochtigheid, en heeft een relatieve stabiliteit in vergelijking met zijn soortgenoten: chloroform en tetrachloorkoolstof..
Het heeft de neiging om te verkolen bij hoge temperaturen (300-450 ºC), wanneer de dampen in contact komen met staal en metaalchloriden.
Ontleding
Kan bij contact met hete oppervlakken of een vlam ontleden, waarbij giftige en irriterende dampen van fosgeen en waterstofchloride vrijkomen..
Corrosie
Dichloormethaan tast sommige vormen van kunststoffen, rubbers en coatings aan.
Warmte van verdamping
28,82 kJ / mol bij 25 ºC.
Oppervlaktespanning
28,20 dynes / cm bij 25 ºC.
Reactiviteit
Dichloormethaan reageert sterk met actieve metalen, zoals kalium, natrium en lithium. Reageert met sterke basen, bijv. Kalium-tert-butoxide. Het is onverenigbaar met bijtende stoffen, oxidatiemiddelen en chemisch actieve metalen.
Bovendien reageert het met vloeibare zuurstof in natrium- en kaliumlegeringen en stikstoftetroxide. In contact met water kan het roestvast staal, nikkel, koper en ijzer aantasten.
Toepassingen
De meeste toepassingen en toepassingen van dichloormethaan zijn gebaseerd op zijn eigenschappen als oplosmiddel. Vanwege deze eigenschap wordt dichloormethaan gebruikt in de voedsel-, transport-, medicijnproductie-industrieën, enz..
Voedselverwerking
Dichloormethaan wordt gebruikt bij het cafeïnevrij maken van koffiebonen en theebladeren. Het wordt ook gebruikt voor de extractie van hop voor bier, dranken en andere smaakstoffen voor voedsel, evenals voor de verwerking van kruiden..
Farmaceutische industrie
Dichloormethaan wordt gebruikt voor de bereiding van cefalosporine en ampicilline, naast de productie van antibiotica, steroïden en vitamines.
Fotografie
Het wordt ook gebruikt als oplosmiddel bij de productie van cellulosetriacetaat (CTA), gebruikt bij het maken van veiligheidsfolies.
Elektronische industrie
Het is een ideale samenstelling voor de productie van printplaten, die wordt gebruikt om het aluminium oppervlak te ontvetten voordat de fotolaklaag op de plaat wordt aangebracht..
Verven
Dichloormethaan is een oplosmiddel dat wordt aangetroffen in vernissen en verfafscheiders en dat wordt gebruikt om vernissen of verflagen van verschillende soorten oppervlakken te verwijderen..
Vervoer
Het wordt gebruikt om metalen onderdelen en oppervlakken in spoorwegmaterieel en vliegtuigonderdelen te ontvetten.
Andere gebruiken
Het wordt gebruikt als spuitdrijfgas (spuitbussen) en als blaasmiddel voor polyurethaanschuim. Het wordt ook gebruikt als vloeistof in sommige soorten kerstverlichting.
Toxiciteit
Acute effecten
Inademing van dichloormethaan kan irritatie van de bovenste luchtwegen, hoesten, piepende ademhaling of kortademigheid veroorzaken..
Het kan roodheid van de huid veroorzaken en als de verbinding er lang op blijft zitten, kan dit chemische brandwonden veroorzaken. In contact met de ogen veroorzaakt dichloormethaan een ernstige irritatie die zich kan uitbreiden tot brandwonden.
Bovendien werkt het als een neurotoxine dat visuele, auditieve en psychomotorische stoornissen veroorzaakt; maar deze effecten zijn omkeerbaar wanneer de inademing van dichloormethaan wordt gestopt.
Chronische effecten
Dichloormethaan kan het centrale zenuwstelsel aantasten en hoofdpijn, mentale verwarring, misselijkheid, braken en geheugenverlies veroorzaken..
Bij dieren heeft het schadelijke effecten op de lever, de nieren, het centrale zenuwstelsel en het cardiovasculaire systeem.
Met betrekking tot carcinogenese is er geen significante toename van het aantal sterfgevallen door kanker gemeld bij werknemers die zijn blootgesteld aan dichloormethaan. Dierstudies hebben echter een toename laten zien die toe te schrijven is aan dichloormethaan in de incidentie van lever- en longkanker, evenals goedaardige tumoren van de borstklieren..
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5ta Editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. (10th editie.). Wiley plus.
- Nationaal centrum voor informatie over biotechnologie. (2020). Dichloormethaan. PubChem-database., CID = 6344. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Dichloormethaan. Hersteld van: en.wikipedia.org
- Brumer. (14 juli 2018). Dichloormethaan. Hersteld van: brumer.com
- MSDS online. (2019). Informatie over gevaren en veiligheid van dichloormethaan (methyleenchloride). Hersteld van: msdsonline.com
- EPA. (2000). Methyleenchloride (dichloormethaan). [Pdf]. Hersteld van: epa.gov



Niemand heeft nog op dit artikel gereageerd.