
Natriumdichromaat (Na2Cr2O7) eigenschappen, productie, gebruik

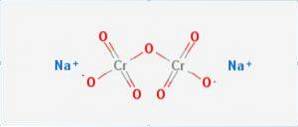
De natriumdichromaat het is een anorganische verbinding met de formule Na2Cr2O7. Het is een van de vele zeswaardige chroomverbindingen (Cr VI). De structuur wordt geïllustreerd in figuur 1, hoewel het zout meestal wordt verwerkt in zijn gedehydrateerde vorm, waarvan de formule Na2Cr2O7 · H2O zou zijn.
Het heeft twee ionische bindingen tussen natriummoleculen en negatief geladen zuurstof. Chroomerts wordt gewonnen uit natriumdichromaat. Jaarlijks worden miljoenen kilo's natriumdichromaat geproduceerd.
China is de grootste producent van natriumdichromaat, maar Chinese chemische fabrieken hebben een relatief lage productie, minder dan 50.000 ton per jaar, vergeleken met de Kazachse fabriek die meer dan 100.000 ton per jaar produceert..
Fabrieken in Rusland, de Verenigde Staten en het Verenigd Koninkrijk hebben een tussenproductie tussen 50.000 en 100.000 ton per jaar (Kogel, 2006).
In termen van reactiviteit en uiterlijk heeft natriumdichromaat vergelijkbare eigenschappen als kaliumdichromaat, maar het natriumzout is beter oplosbaar in water en heeft een lager equivalentgewicht dan het kaliumzout..
Natriumdichromaat produceert bij verhitting giftige chroomdampen. Het is een sterk oxidatiemiddel en is zeer corrosief.
Deze verbinding is te vinden in verontreinigde drinkwaterbronnen van verschillende industriële processen, zoals galvaniseren of galvaniseren, leerlooien en textielproductie..
Artikel index
- 1 Fysische en chemische eigenschappen
- 2 Productiemethoden
- 3 Reactiviteit en gevaren
- 4 Gebruik en toepassingen
- 5 Biochemie
- 6 referenties
Fysische en chemische eigenschappen
Natriumdichromaat is samengesteld uit kristallen met een monokliene structuur die roodachtig oranje van kleur zijn in hun watervrije en reukloze vorm. Het molecuulgewicht is 261,97 g / mol in zijn watervrije vorm en 298,00 g / mol in zijn dihydraatvorm..
Het heeft een smeltpunt van 356,7 graden Celsius, een kookpunt van 400 graden Celsius waarbij het uiteenvalt. Het heeft een dichtheid van 2,52 g / ml.

Het uiterlijk van natriumdichromaat wordt getoond in Figuur 2. De oplosbaarheid in water is 187 g per 100 gram bij 25 graden Celsius en de oplosbaarheid in ethanol is 513,2 gram per liter bij 19,4 graden Celsius (National Center for Biotechnology Information, n.d.).
Het wordt als een stabiele verbinding beschouwd als het onder de aanbevolen omstandigheden wordt bewaard en het niet ontvlambaar is. Omdat het een sterk oxidatiemiddel is, is het corrosief, en in oplossing is het zuur met het vermogen om de pH te verlagen tot 4 in een 1% w / v oplossing..
Productie methodes
Natriumchromaat kan worden omgezet in dichromaat via een continu proces dat zich bezighoudt met zwavelzuur, kooldioxide of een combinatie van deze twee..
De verdamping van de natriumdichromaatvloeistof veroorzaakt het neerslaan van natriumsulfaat en / of natriumbicarbonaat, en deze verbindingen worden verwijderd vóór de uiteindelijke kristallisatie van natriumdichromaat..
Natriumdichromaat kan in drie stappen worden gemaakt:
- Oxidatieomstandigheden voor alkalisch gebrand chromiet
- Uitloging. Extractie van oplosbare stoffen uit een mengsel door de werking van een vloeibaar oplosmiddel
- Omzetting van natriummonochromaat in natriumdichromaat door middel van een zuur.
Watervrij natriumdichromaat kan worden bereid door natriumdichromaatdihydraat te smelten, waterige dichromaatoplossingen boven 86 ° C te kristalliseren of door natriumdichromaatoplossingen in sproeidrogers te drogen..
Natriumdichromaatoplossingen met 69 en 70% w / v worden gebruikt als een gemakkelijke en kosteneffectieve methode voor het verzenden van hoeveelheden, waardoor handmatige behandeling of kristaloplossing niet nodig is..
Reactiviteit en gevaren
Het is een sterk oxidatiemiddel. Onverenigbaar met sterke zuren. Contact met brandbare materialen kan brand veroorzaken. Giftige chroomoxidedampen kunnen worden gevormd in aanwezigheid van hitte of vuur.
Het bekende "chroomzuurmengsel" van dichromaat en zwavelzuur met organische resten geeft aanleiding tot een heftige exotherme reactie. Dit mengsel in combinatie met acetonresten leidt ook tot een heftige reactie..
De combinatie van dichromaat en zwavelzuur met alcoholen, ethanol en 2-propanol geeft aanleiding tot een heftige exotherme reactie. Omdat er veel incidenten zijn waarbij dichromaat-zwavelzuur wordt gemengd met oxideerbare organische materialen, is het waarschijnlijk het beste om dergelijke interacties te vermijden..
De combinatie van dichromaat met hydrazine is explosief, de reactie van dichromaat is naar verwachting krachtig met aminen in het algemeen. De toevoeging van het gedehydrateerde dichromaatzout aan azijnzuuranhydride leidt tot een uiteindelijk explosieve exotherme reactie..
Boor, silicium en dichromaten vormen pyrotechnische mengsels. Een mengsel van azijnzuur, 2-methyl-2-pentenal en dichromaat leidt tot een ongebreidelde reactie (Chemical Datasheet Sodium Dichromate., 2016).
Het inademen van stof of nevel veroorzaakt irritatie van de luchtwegen die soms op astma lijkt. Septumperforatie kan optreden. Het wordt als gif beschouwd.
Inslikken veroorzaakt braken, diarree en, zeer ongebruikelijk, maag- en niercomplicaties. Contact met ogen of huid veroorzaakt plaatselijke irritatie. Herhaalde blootstelling van de huid veroorzaakt dermatitis.
Natriumdichromaat is kankerverwekkend voor mensen. Er zijn aanwijzingen dat zeswaardig chroom of Cr (VI) -verbindingen longkanker bij mensen kunnen veroorzaken. Van natriumdichromaat is aangetoond dat het bij dieren longkanker veroorzaakt.
Hoewel natriumdichromaat niet is geïdentificeerd als een teratogene of reproductieve risicoverbinding, is het bekend dat zeswaardige chroom- of Cr (VI) -verbindingen teratogenen zijn en reproductieve schade kunnen veroorzaken, zoals het verminderen van de vruchtbaarheid en het verstoren van de menstruatiecyclus..
Natriumdichromaat kan lever- en nierbeschadiging veroorzaken, dus het moet met uiterste zorg worden behandeld (New Jersey Department of Health, 2009).
Bij inslikken moet het slachtoffer water of melk drinken; nooit braken opwekken. In geval van contact met de huid of de ogen, moet het worden behandeld als brandwonden door zuur; spoel hun ogen met water gedurende tenminste 15 minuten.
Externe laesies kunnen worden ingewreven met een 2% natriumthiosulfaatoplossing. In alle gevallen dient een arts te worden geraadpleegd.
Toepassingen en toepassingen
Naast het belang ervan bij de vervaardiging van andere chroomchemicaliën, heeft natriumdichromaat ook veel directe toepassingen als ingrediënt bij de productie van:
- Metallic afwerking: helpt corrosiebestendigheid en reinigt metalen oppervlakken, bevordert ook de hechting van de verf.
- Biologische producten: gebruikt als oxidatiemiddel bij de vervaardiging van producten zoals vitamine K en was.
- Pigmenten: gebruikt bij de vervaardiging van anorganische chromaatpigmenten, waar het een reeks lichtbestendige kleuren produceert. Sommige soorten chromaat worden ook gebruikt als corrosieremmers in onderlagen en primers..
- Keramiek: gebruikt bij de bereiding van gekleurd glas en keramische glazuren.
- Textiel: gebruikt als bijtmiddel voor zure kleurstoffen om hun snelle kleureigenschappen te verbeteren.
- Chroomsulfaatproductie.
(Natriumdichromaat. De bouwsteen voor vrijwel alle andere chroomverbindingen., 2010-2012)
Natriumdichromaatdihydraat, ideaal voor gebruik in verschillende omstandigheden, waaronder toepassingen bij hoge temperaturen, zoals keramische glazuren en gekleurd glas.
Chroomoxide, dat harder is dan andere metaaloxiden, zoals titanium of ijzer, is ideaal voor omgevingen waar de temperatuur en procesomstandigheden agressief zijn.
Deze stof wordt voornamelijk gebruikt om andere chroomverbindingen te produceren, maar wordt ook gebruikt in bentonietslib dat wordt gebruikt bij de olieproductie, in houtconserveringsmiddelen, bij de productie van organische chemicaliën en als corrosieremmer..
Bij menging met kaliumaluminiumdichromaat, met behulp van het aluminium-thermische proces, produceert chroomoxide zeer zuiver metallisch chroom. Dit is een essentieel ingrediënt bij de productie van hoogwaardige superlegeringen die in de lucht- en ruimtevaartindustrie worden gebruikt..
Bij organische synthese wordt natriumdichromaat gebruikt als oxidatiemiddel bij oxidatiereductiereacties in aanwezigheid van zwavelzuur..
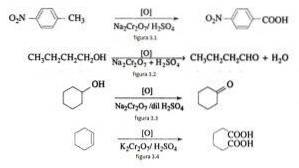
Bijvoorbeeld de oxidatie van p-nitrotolueen tot p-nitrobenzoëzuur, bij de oxidatie van n-butanol tot n-butaldehyde, bij de vorming van cyclohexanon uit cyclohexanol en de vorming van adipinezuur zoals geïllustreerd in figuren 3.1, 3.2, 3.3 en 3.4 respectievelijk (VK Ahluwalia, 2004).
Biochemie
Intratracheale indruppeling van natriumdichromaat (CrVI) en chroomacetaathydroxide (CrIII) bij mannelijke ratten resulteerde in verhoogde concentraties chroom in volbloed, plasma en urine tot 72 uur na blootstelling; Piekconcentraties werden 6 uur na blootstelling bereikt..
De verhouding van chroom in vol bloed tot chroomconcentraties in plasma was significant verschillend voor de behandelingen met Cr (VI) en Cr (III). Daarom moeten bloedchroom- en plasmachroomtesten worden gebruikt voor de beoordeling van de chroomblootstelling..
Chroom werd ook gedetecteerd in perifere lymfocyten. Cr (VI), maar niet Cr (III) stapelden zich significant op in lymfocyten na behandeling. Deze cellen kunnen worden gebruikt als biomarkers bij de evaluatie van blootstelling aan chroomverbindingen (Hooth, 2008).
Referenties
- Chemisch gegevensblad Natriumdichromaat. (2016). Opgehaald uit camee-chemicaliën: cameochemicals.noaa.
- Hooth, M. J. (2008). Technisch rapport over toxicologie en carcinogenese-onderzoeken van natriumdichromaat gedihydrateerd. National Institute of Health USA.
- Kogel, J. E. (2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses Seventh Edition. littleton colorado: samenleving van mijnbouw, metallurgie en exploratie inc.
- Nationaal centrum voor informatie over biotechnologie. (s.f.). PubChem samengestelde database; CID = 25408. Opgehaald van pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Ministerie van Volksgezondheid van New Jersey. (2009, november). informatieblad over gevaarlijke stoffen natriumdichromaat. Opgehaald van nj.gov: nj.gov.
- Natriumdichromaat. De bouwsteen voor vrijwel alle andere chroomverbindingen. (2010-2012). Opgehaald van elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Uitgebreide praktische organische chemie: voorbereidingen en kwantitatieve analyses. Delhi: University Press (India).


Niemand heeft nog op dit artikel gereageerd.