
Koolstofdisulfide (CS2) structuur, eigenschappen, gebruik, risico's
De koolstofdisulfide Het is een verbinding die wordt gevormd door de vereniging van een koolstofatoom (C) en twee zwavelatomen (S). De chemische formule is CStwee. Het is een kleurloze of lichtgele vloeistof met een onaangename geur vanwege de onzuiverheden die het bevat (zwavelverbindingen). Als het puur is, ruikt het zacht en zoet, vergelijkbaar met chloroform of ether..
Het is van nature afkomstig van de inwerking van zonlicht op organische moleculen die in zeewater worden aangetroffen. Bovendien wordt het geproduceerd in moeraswater en ook samen met andere gassen uit vulkanen verdreven.
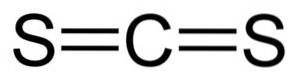
Koolstofdisulfide is een vluchtige vloeistof en is ook licht ontvlambaar, dus het moet uit de buurt worden gehouden van vlammen en vonken of apparaten die deze kunnen produceren, zelfs elektrische gloeilampen..
Het heeft het vermogen om een groot aantal verbindingen, materialen en elementen op te lossen, zoals fosfor, zwavel, selenium, harsen, lakken, enz. Daarom wordt het als oplosmiddel gebruikt.
Het is ook een tussenpersoon bij verschillende industriële chemische reacties, zoals de productie van rayon of kunstzijde..
Het moet met de nodige voorzichtigheid worden gehanteerd en met beschermende werktuigen, aangezien het zeer giftig en gevaarlijk is.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smelt- of stolpunt
- 3.4 Kookpunt
- 3.5 Vlampunt
- 3.6 Zelfontbrandingstemperatuur
- 3.7 Dichtheid
- 3.8 Dampspanning
- 3.9 Oplosbaarheid
- 3.10 Chemische eigenschappen
- 4 Verkrijgen
- 4.1 Aanwezigheid in de natuur
- 5 toepassingen
- 5.1 In de chemische industrie
- 5.2 Bij de productie van rayon en cellofaan
- 5.3 Bij de productie van tetrachloorkoolstof
- 5.4 In verschillende toepassingen
- 5.5 Oude toepassingen
- 6 Risico's
- 7 referenties
Structuur
Koolstofdisulfide heeft één koolstofatoom en twee zwavelatomen aan weerszijden ervan..
De bindingen tussen het koolstofatoom en de zwavelatomen zijn covalent en dubbel, daarom erg sterk. Het CS-molecuultwee heeft een lineaire en symmetrische structuur.

Nomenclatuur
- Koolstofdisulfide
- Koolstofdisulfide
- Dithiocarbonanhydride
Eigendommen
Fysieke toestand
Kleurloze tot geelachtige vloeistof.
Molecuulgewicht
76,15 g / mol
Smelt- of stolpunt
-110,8 ° C
Kookpunt
46,0 ºC
Vlampunt
-30 ºC (methode met gesloten kroes).
Zelfontbranding temperatuur
90 ° C
Dichtheid
Vloeistof = 1,26 g / cm3 bij 20 ºC.
Stoom = 2,67 keer die van lucht.
De dampen zijn meer dan twee keer zo zwaar als lucht en de vloeistof is zwaarder dan water.
Dampdruk
279 mmHg bij 25 ° C.
Dit is een hoge dampspanning.
Oplosbaarheid
Zeer slecht oplosbaar in water: 2,16 g / L bij 25 ° C. Oplosbaar in chloroform. Mengbaar met ethanol, methanol, ether, benzeen, chloroform en tetrachloorkoolstof.
Chemische eigenschappen
De CStwee het verdampt gemakkelijk bij kamertemperatuur omdat het kookpunt erg laag is en de dampspanning erg hoog is.
Koolstofdisulfide is zeer licht ontvlambaar. Zijn dampen ontbranden heel gemakkelijk, zelfs met de hitte van een elektrische gloeilamp. Dit betekent dat het zeer snel reageert met zuurstof:
CStwee + 3 Otwee → COtwee + 2 ZOtwee
Het feit dat het bij kamertemperatuur een hoge dampspanning heeft, maakt het gevaarlijk om in de buurt van een vlam te zijn.
Bij verhitting tot ontbinding kan het gemakkelijk exploderen en giftige zwaveloxidegassen uitstoten. Boven 90 ° C ontbrandt spontaan.
Het valt uiteen als het lange tijd wordt bewaard. Tast koper en zijn legeringen aan. Reageert ook met sommige kunststoffen, rubbers en coatings.
Reageert onder bepaalde omstandigheden met water en vormt carbonylsulfide OCS, kooldioxide COtwee en waterstofdisulfide HtweeS:
CStwee + H.tweeO → OCS + HtweeS
CStwee + 2 uurtweeO → COtwee + 2 uurtweeS
Met alcoholen (ROH) in alkalisch medium vormt xanthaten (RO-CS-SNa):
CStwee + ROH + NaOH → HtweeO + RO-C (= S) -SNa
Het verkrijgen van
Koolstofdisulfide wordt commercieel bereid door zwavel met koolstof te laten reageren. Het proces wordt uitgevoerd bij temperaturen van 750-900 ° C.
C + 2 S → CStwee
In plaats van steenkool kan ook methaan of aardgas worden gebruikt, en zelfs ethaan, propaan en propyleen zijn gebruikt, in welk geval de reactie plaatsvindt bij 400-700 ° C met een hoge opbrengst..
Het kan ook worden bereid door aardgas te laten reageren met waterstofsulfide HtweeS bij zeer hoge temperatuur.
Aanwezigheid in de natuur
De CStwee het is een natuurlijk product dat in zeer kleine hoeveelheden (sporen) in de atmosfeer aanwezig is. Het wordt fotochemisch geproduceerd in oppervlaktewater.
De inwerking van zonlicht op bepaalde verbindingen die in zeewater aanwezig zijn, zoals cysteïne (een aminozuur), leidt tot de vorming van koolstofdisulfide.

Het komt ook van nature vrij tijdens vulkaanuitbarstingen en wordt in kleine hoeveelheden boven moerassen aangetroffen..
Normaal gesproken worden we blootgesteld aan het inademen in zeer kleine hoeveelheden en het is aanwezig in sommige voedingsmiddelen. Het wordt ook aangetroffen in sigarettenrook.
In de omgeving wordt het afgebroken door zonlicht. Op de grond beweegt het erdoorheen. Sommige micro-organismen in de bodem breken het af.
Toepassingen
In de chemische industrie
Koolstofdisulfide is een belangrijke chemische verbinding omdat het wordt gebruikt om andere chemicaliën te bereiden. Kan als chemisch tussenproduct fungeren.
Het wordt ook gebruikt als procesoplosmiddel om bijvoorbeeld fosfor, zwavel, selenium, broom, jodium, vetten, harsen, was, lakken en gommen op te lossen.
Maakt de productie van onder andere geneesmiddelen en herbiciden mogelijk.
Bij de productie van rayon en cellofaan
Met de CStwee xanthaten worden bereid, dit zijn verbindingen die worden gebruikt bij de vervaardiging van rayon en cellofaan.
Om kunstzijde of rayon te verkrijgen, wordt cellulose gebruikt, die wordt behandeld met alkali en koolstofdisulfide CStwee en wordt omgezet in cellulosexanthaat, oplosbaar in alkali. Deze oplossing is stroperig en wordt daarom "stroperig" genoemd.
De viscose wordt in een zuurbad door zeer kleine gaatjes geperst. Hier wordt het cellulosexanthaat weer omgezet in cellulose die onoplosbaar is en worden lange en glanzende draden gevormd..
De draden of filamenten kunnen worden gesponnen tot een materiaal dat bekend staat als rayon.
(1) Cellulose + NaOH → alkalicellulose
ROH + NaOH → RONa
(2) Alkalicellulose + koolstofdisulfide → Cellulosexanthaat
RONa + S = C = S → RO-C (= S) -SNa
(3) Cellulose xanthaat + zuur → Cellulose (filamenten)
RO-C (= S) -SNa + zuur → ROH

Als de cellulose wordt neergeslagen door het xanthaat door een nauwe sleuf te leiden, wordt de cellulose geregenereerd in de vorm van dunne vellen die het cellofaan vormen. Dit wordt verzacht met glycerol en wordt gebruikt als beschermfolie voor voorwerpen.

Bij de productie van tetrachloorkoolstof
Koolstofdisulfide reageert met chloor Cltwee om tetrachloorkoolstof CCl te geven4, dat is een belangrijk niet-brandbaar oplosmiddel.
CStwee + 3 Cltwee → CCl4 + StweeCltwee
In verschillende toepassingen
Koolstofdisulfide neemt deel aan de koude vulkanisatie van rubbers, dient als tussenproduct bij de productie van pesticiden en wordt gebruikt om katalysatoren te genereren in de olie-industrie en bij de productie van papier..
Xanthates bereid met CStwee worden gebruikt bij minerale flotatie.
Oude toepassingen
De CStwee het is een gif voor levende organismen. Vroeger werd het gebruikt om ongedierte zoals ratten, marmotten en mieren te vernietigen, waarbij de vloeistof in een gesloten ruimte werd gegoten waarin deze dieren leefden (holen en mierenhopen).
Bij gebruik voor dit doel vernietigden de dichte giftige dampen elk levend organisme dat zich in de besloten ruimte bevond..
Het werd ook gebruikt als anthelminticum voor dieren en om de larven van de bromvlieg uit de maag van paarden te verwijderen..
In de landbouw werd het gebruikt als insecticide en nematicide, om de grond te ontsmetten, voor het ontsmetten van kwekerijen, graanschuren, silo's en graanmolens. Ook werden spoorwagons, schepen en pontons bespoten.

Al deze toepassingen waren verboden vanwege de hoge ontvlambaarheid en toxiciteit van CStwee.
Risico's
De CStwee het is licht ontvlambaar. Veel van hun reacties kunnen brand of explosies veroorzaken. Mengsels van zijn dampen met lucht zijn explosief. Bij ontsteking produceert het irriterende of giftige gassen.
Koolstofdisulfide mag niet in de riolering worden gegoten, omdat er een mengsel van CS in de buizen achterblijfttwee en lucht die een explosie kan veroorzaken als deze per ongeluk wordt ontstoken.
Zijn dampen ontbranden spontaan bij contact met vonken of hete oppervlakken.
Koolstofdisulfide irriteert ernstig de ogen, huid en slijmvliezen.
Bij inademing of inslikken heeft het ernstige gevolgen voor het centrale zenuwstelsel, het cardiovasculaire systeem, de ogen, de nieren en de lever. Het kan ook door de huid worden opgenomen en schade veroorzaken.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2020). Koolstofdisulfide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Mopper, K. en Kieber, D.J. (2002). Fotochemie en de cycli van koolstof, zwavel, stikstof en fosfor. In Biogeochemistry of Marine Dissolved Organic Matter. Opgehaald van sciencedirect.com.
- Meyer, B. (1977). Industrieel gebruik van zwavel en zijn verbindingen. Koolstofdisulfide. In zwavel, energie en milieu. Opgehaald van sciencedirect.com.
- Pohanish, R.P. (2012). C. Koolstofdisulfide. In Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens (Sixth Edition). Opgehaald van sciencedirect.com.
- Morrison, R.T. en Boyd, R.N. (2002). Organische chemie. 6e editie. Prentice-Hall.
- Windholz, M. et al. (redactie) (1983). De Merck Index. Een encyclopedie van chemicaliën, medicijnen en biologische producten. Tiende editie. Merck & CO., Inc.



Niemand heeft nog op dit artikel gereageerd.