
Concepten en voorbeelden van chemische deelbaarheid

We kunnen de deelbaarheid in de chemie als een eigenschap van materie waardoor het in kleinere porties kan worden gescheiden. Om het concept te begrijpen, kunnen we een voorbeeld geven.
Als we een brood nemen en het keer op keer doormidden snijden, zullen we dan ooit bij een fundamenteel blok materie komen dat niet verder kan worden verdeeld? Deze vraag speelt al duizenden jaren in de hoofden van wetenschappers en filosofen.
Oorsprong en concept van chemische deelbaarheid
Lange tijd werd er gedebatteerd of materie uit deeltjes bestond (wat we tegenwoordig kennen als atomen), maar het algemene idee was dat materie een continuüm was dat kon worden verdeeld.
Dit wijdverbreide concept maakte briljante wetenschappers zoals James Clerk Maxwell (van Maxwell's vergelijkingen) en Ludwing Boltzman (van de Boltzman-distributie) het slachtoffer van spot, waardoor de eerste tot waanzin werd gedreven en de laatste tot zelfmoord..
In de 5e eeuw voor Christus gebruikten de Griekse filosoof Leucippus en zijn leerling Democritus het woord atomen om het kleinste individuele stukje materie aan te duiden en stelden ze voor dat de wereld uit niets meer bestaat dan bewegende atomen..
Deze vroege atoomtheorie verschilde van latere versies doordat ze het idee omvatte van een menselijke ziel die bestaat uit een meer verfijnd type atoom dat door het lichaam is verdeeld..
De atoomtheorie raakte in de middeleeuwen in verval, maar herleefde aan het begin van de wetenschappelijke revolutie in de 17e eeuw..
Isaac Newton, bijvoorbeeld, geloofde dat materie bestond uit 'vaste, massieve, harde, ondoordringbare en mobiele deeltjes'..
De deelbaarheid kan op verschillende manieren gebeuren, de meest voorkomende is de deelbaarheid door fysieke methoden, bijvoorbeeld het hakken van een appel met een mes.
Deelbaarheid kan echter ook optreden door chemische methoden waarbij materie wordt gescheiden in moleculen of atomen.
10 voorbeelden van chemische deelbaarheid
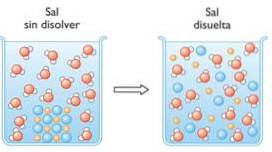
1- Los zout op in water
Wanneer een zout, bijvoorbeeld natriumchloride, wordt opgelost in water, treedt een oplossingsverschijnsel op waarbij de ionische bindingen van het zout worden verbroken:
NaCl → Na+ + Cl-
Door slechts een korreltje zout in water op te lossen, scheidt het zich in oplossing in miljarden natrium- en chloride-ionen..
2- Oxidatie van metalen in zuur milieu
Alle metalen, bijvoorbeeld magnesium of zink, reageren met zuren, bijvoorbeeld verdund zoutzuur om waterstofbellen en een kleurloze oplossing van het metaalchloride te geven.
Mg + HCl → Mgtwee+ +Cl- + H.twee
Het zuur oxideert het metaal en scheidt de metaalverbindingen om ionen in oplossing te verkrijgen (BBC, 2014).
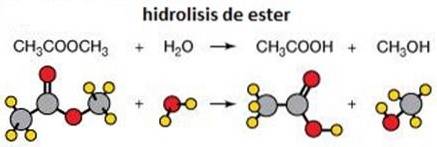
3- Hydrolyse van esters
Hydrolyse is het verbreken van een chemische binding door water. Een voorbeeld van hydrolyse is de hydrolyse van esters waarbij deze worden verdeeld in twee moleculen, een alcohol en een carbonzuur..
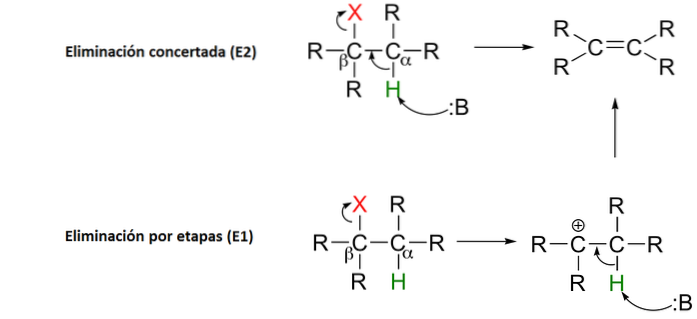
4- Eliminatiereacties
Een eliminatiereactie doet precies wat het zegt: het verwijdert atomen uit een molecuul. Dit wordt gedaan om een dubbele koolstof-koolstofbinding te creëren. Dit kan gedaan worden met een base of een zuur.
Het kan plaatsvinden in een enkele gecoördineerde stap (de abstractie van het proton op Cα vindt tegelijkertijd plaats met de splitsing van de Cβ-X-binding), of in twee stappen (de splitsing van de Cβ-X-binding vindt eerst plaats om een tussenliggende carbocatie, die vervolgens 'uitschakelt' door de abstractie van het proton in de alfakoolstof).
5- Enzymatische reactie van aldolase
In de voorbereidende fase van glycolyse wordt één molecuul glucose opgesplitst in twee moleculen glyceraldehyde 3-fosfaat (G3P) met behulp van 2 ATP.
Het enzym dat verantwoordelijk is voor deze incisie is aldolase, dat door omgekeerde condensatie het fructose-1,6-bisfosfaatmolecuul in een G3P-molecuul in tweeën deelt en een dihydroxyacetonfosfaatmolecuul dat later wordt geïsomeriseerd om een ander molecuul van G3P te vormen..
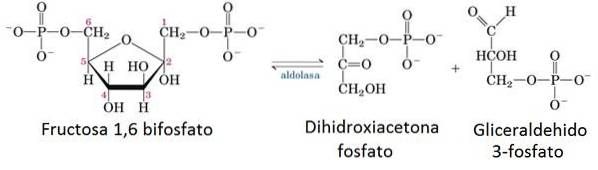
6- Afbraak van biomoleculen
Niet alleen glycolyse, maar alle afbraak van biomoleculen in katabolismereacties zijn voorbeelden van chemische deelbaarheid.
Dit komt omdat ze vertrekken van grote moleculen zoals koolhydraten, vetzuren en eiwitten om kleinere moleculen te produceren, zoals acetyl CoA die de Krebs-cyclus binnengaat om energie te produceren in de vorm van ATP..
7- Verbrandingsreacties
Dit is een ander voorbeeld van chemische deelbaarheid, aangezien complexe moleculen zoals propaan of butaan reageren met zuurstof om CO te produceren.twee en water:
C3H.8 + 5Otwee → 3COtwee + 4HtweeOF
De afbraak van biomoleculen zou een verbrandingsreactie kunnen zijn, aangezien de eindproducten CO zijntwee en water, maar deze worden in veel stappen gegeven met verschillende tussenpersonen.
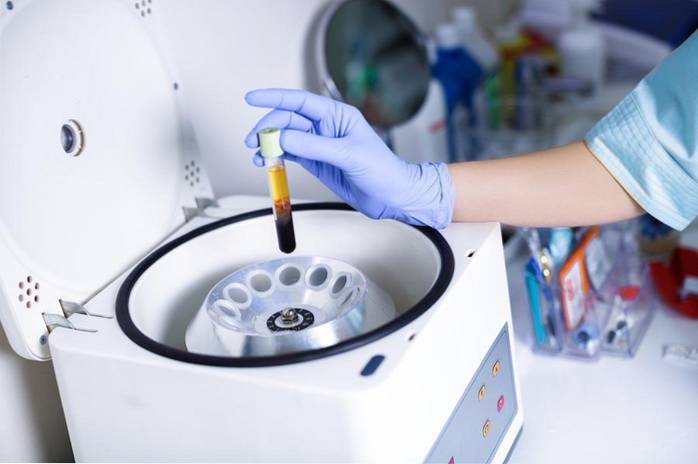
8- Centrifugeren van bloed
De scheiding van de verschillende componenten van bloed is een voorbeeld van deelbaarheid. Ondanks dat het een fysiek proces is, lijkt het voorbeeld mij interessant omdat de componenten door middel van centrifugeren worden gescheiden door verschil in dichtheid.
De dichtste componenten, het serum met de rode bloedcellen, blijven op de bodem van de centrifugebuis terwijl de minder dichte componenten, het plasma, bovenaan blijven..
9- Bicarbonaatbuffer
Natriumbicarbonaat, HCO3- Het is de belangrijkste manier om CO te transporterentwee in het lichaam product van metabolische afbraakreacties.
Deze verbinding reageert met een proton in het medium om koolzuur te produceren dat vervolgens wordt verdeeld in CO2 en water:
HCO3- + H.+ D HtweeCO3 D COtwee + H.tweeOF
Omdat de reacties omkeerbaar zijn, is dit een manier waarop het organisme, door middel van ademhaling, de fysiologische pH onder controle kan houden om processen van alkalose of acidose te vermijden..
10- Verdeling van het atoom of kernsplijting
In het geval dat een enorme kern (zoals uranium-235) kapot gaat (splijtingen), zal dit resulteren in een netto energieopbrengst. Dit komt doordat de som van de massa's van de fragmenten kleiner zal zijn dan de massa van de uraniumkern..
In het geval dat de massa van de fragmenten gelijk is aan of groter is dan die van ijzer op de piek van de bindingsenergiekromme, zullen de kerndeeltjes nauwer gebonden zijn dan in de uraniumkern en vindt deze afname in massa plaats in energievorm volgens volgens de vergelijking van Einstein.
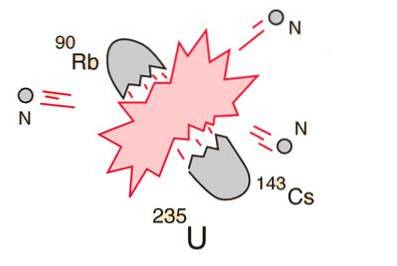
Voor elementen die lichter zijn dan ijzer, zal fusie energie produceren. Dit concept leidde tot de oprichting van de atoombom en kernenergie..
Referenties
- AJ Software en multimedia. (2015). Kernsplijting: basisprincipes. Opgehaald van atomicarchive.com.
- (2014). Reacties van zuren. Opgehaald van bbc.co.uk.
- Clark, J. (2016, januari). HYDROLYSE ESTERS. Opgehaald van chemguide.co.uk.
- Foist, L. (S.F.). Eliminatiereacties in de organische chemie. Opgehaald van study.com.
- Miller, W. A. (1867). Elementen van de chemie: theoretisch en praktisch, deel 1. New York: John Wiley en zoon.
- Kernsplijting. (S.F.). Hersteld van hyperfysica.
- Pratt, D. (1997, november). De oneindige deelbaarheid van materie. Opgehaald van davidpratt.info.
- Soderberg, T. (2016, 31 mei). Eliminatie door de E1- en E2-mechanismen. Hersteld van chem.libretext.

Niemand heeft nog op dit artikel gereageerd.