
Chloordioxide (ClO2) structuur, gebruiken, verkrijgen, risico's, eigenschappen

De chloordioxide Het is een anorganische verbinding gevormd door het element chloor (Cl) en zuurstof (O). De chemische formule is ClOtwee. Het is een groenachtig geel tot roodachtig gas. Het komt van nature niet voor in het milieu.
Het is extreem reactief, dus het is normaal dat het wordt voorbereid waar het moet worden gebruikt. Een van de belangrijkste toepassingen is als microbicide, antisepticum en deodorant, omdat het bacteriën, virussen en schimmels heel gemakkelijk en in zeer lage concentraties elimineert..

Hiermee kunt u voedingsmiddelen zoals groenten, fruit, vlees, gevogelte en zeevruchten desinfecteren. Het wordt gebruikt voor het reinigen van oppervlakken, vloeren, badkamers, ventilatiesystemen, zwembaden, laboratoriumapparatuur, tandheelkundige apparatuur, enz..
Om deze reden wordt het gebruikt in de voedselverwerking, in ziekenhuizen en klinieken, in industrieën en winkels. Het wordt gebruikt om drinkwater en gemeentelijk afvalwater te zuiveren.
Het is zeer effectief als oxidatiemiddel, daarom wordt het gebruikt om onder meer papierpulp, oliën, meel, leer, textielvezels te bleken..
Als het in de vorm van een gas is, is het erg gevaarlijk, omdat het zeer explosief is, en het wordt voornamelijk gebruikt in waterige oplossingen. Het is giftig bij inademing.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3.7 Chemische eigenschappen
- 3.8 Eigenschappen van zijn waterige oplossingen
- 3.9 Overige eigenschappen
- 4 Verkrijgen
- 5 Gebruikt als ontsmettingsmiddel
- 5.1 In voedsel
- 5.2 Op papier en karton dat in aanraking komt met voedsel
- 5.3 In drinkwater
- 5.4 In de tandheelkunde
- 5.5 In medische toepassingen
- 6 Andere toepassingen
- 7 Risico's
- 8 referenties
Structuur
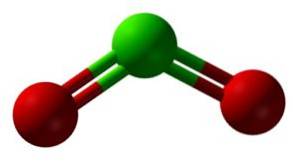
Chloordioxide wordt gevormd door de vereniging van een chlooratoom (Cl) met twee zuurstofatomen (O). De bindingen van chloor met elke zuurstof zijn covalent en dubbel. Chloor in deze verbinding heeft een valentie van +4.
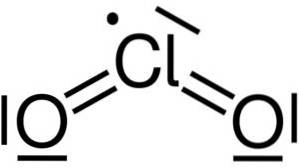
Het heeft een symmetrische en gehoekte structuur, omdat het vrije elektronen heeft. Dat wil zeggen, ze vormen geen binding met een ander atoom.
Nomenclatuur
- Chloordioxide
- Chlooroxide (iv)
Eigendommen
Fysieke toestand
Groenachtig geel tot roodachtig geel gas.
Molecuulgewicht
67,45 g / mol.
Smeltpunt
-59 ºC.
Kookpunt
11 ºC.
Dichtheid
Vloeistof bij 0 ° C = 1.642 g / cm3
Gas = 2,33 (relatieve dichtheid ten opzichte van lucht, lucht = 1).
Oplosbaarheid
Oplosbaar in water: 2000 cm3 van de ClOtwee gas in 100 cm3 koud water of 0,8 g / 100 ml water bij 20 ° C. Oplosbaar in alkalische oplossing en in zwavelzuuroplossing H.tweeSW4.
Chemische eigenschappen
De ClOtwee het is extreem reactief en kan heftig exploderen. Het is een zeer effectief oxidatiemiddel.
De ClOtwee het ontleedt heftig als het in contact komt met organische materialen. Als het zich in de lucht bevindt met een concentratie van meer dan 10%, kan het exploderen als gevolg van zonlicht of hitte.
Het kan ook ontploffen in aanwezigheid van kwik (Hg) of koolmonoxide (CO).
Onder invloed van ultraviolet (UV) licht of ozon, ClOtwee wordt chloorhexoxide CltweeOF6, zeer onstabiele verbinding.
Eigenschappen van uw waterige oplossingen
De waterige oplossingen zijn geel of roodachtig geel. Ze zijn stabiel als ze koel, goed afgesloten en beschermd tegen zonlicht worden bewaard. In aanwezigheid van licht ontleden deze oplossingen langzaam om zoutzuur HCl en chloorzuur HClO te geven.3.

In alkalische oplossingen, ClOtwee ontleedt in chlorietionen ClOtwee- en Chloraat ClO3-. Chloorzuur HClO wordt gevormd in zure oplossingentwee en dan ontleedt dit tot zoutzuur HCl en chloorzuur HClO3.
Andere eigenschappen
De geconcentreerde dampen van ClOtwee ze zijn potentieel explosief, dus het was niet mogelijk om het alleen samen te persen of gemengd met andere gassen. Om deze reden verdient het de voorkeur om het voor te bereiden op de plaats waar het zal worden gebruikt..
Wanneer het in zijn gehydrateerde vorm bij zeer lage temperaturen is, wat de manier is waarop het soms wordt overgedragen, is het een blokvormige vaste stof die lijkt op ijs en oranje van kleur..
Het heeft een geur die lijkt op chloor. Het is giftig bij inademing.
Het verkrijgen van
Het kan op verschillende manieren worden verkregen. Bijvoorbeeld in sommige gevallen ClO-oplossingentwee worden bereid door een mengsel van chloorgas (Cltwee) en lucht (of chloorgas en stikstof Ntwee) door een kolom met natriumchlorietgranulaat (NaClOtwee.
2 NaClOtwee + Cltwee → 2 NaCl + 2 ClOtwee
Het gegenereerde product bevat ongeveer 90% ClOtwee, onder andere chloorverbindingen.
Het wordt ook verkregen uit kaliumchloraat (KClO3) en zwavelzuur (H.tweeSW4) in aanwezigheid van oxaalzuur als reductiemiddel. In dit geval kooldioxide (COtwee) gebruikt om de ClO te verdunnentwee.
Het kan op de plaats van gebruik worden bereid uitgaande van natriumchloraat (NaClO3), zwavelzuur (H.tweeSW4) en methanol (CH3OH).
In de industrie wordt het verkregen door natriumchloraat (NaClO3) en zwaveldioxide (SOtwee) in aanwezigheid van zwavelzuur.
2 NaClO3 + SWtwee + H.tweeSW4 → 2 ClOtwee + 2 NaHSO4
Gebruikt als ontsmettingsmiddel
Het kan worden gebruikt als een krachtig antimicrobieel middel. Het is zeer effectief gebleken tegen verschillende micro-organismen, zoals de Escherichia coli en de Staphylococcus aureus.
Bij dat laatste is een concentratie van slechts 5 ppm ClO voldoendetwee om 100% van hen te elimineren. Het is bacteriedodend, antiseptisch en geurverdrijvend. Het is effectief over een breed pH-bereik.
In eten
Het wordt gebruikt als antimicrobieel middel in water om fruit en groenten te ontsmetten, bij de verwerking van gevogelte, rood vlees, zowel stukken vlees als organen, en zeeproducten zoals schaaldieren..

Chloordioxide-oplossingen moeten worden gebruikt in een concentratie van maximaal 3 ppm (delen per miljoen) ClOtwee residu, zodat het geen effect heeft op voedsel.
Na behandeling met ClOtwee al het voedsel moet grondig worden afgespoeld met drinkwater of is bedoeld om te blancheren, koken of inblikken.
In het geval van maritieme producten, de ClO-oplossingtwee Het moet worden gebruikt in water en ijs dat wordt gebruikt bij spoelen, wassen, ontdooien, transport of opslag. Rauwe schaaldieren moeten voor consumptie grondig worden gewassen met drinkwater..

Op papier en karton dat in aanraking komt met voedsel
ClO-oplossingentwee worden gebruikt om slijmveroorzakende micro-organismen (zoals algen, bacteriën en schimmels) te elimineren in het proceswater dat wordt gebruikt bij de productie van papier en karton dat in contact komt met voedsel.
In drinkwater
Het wordt gebruikt om water te zuiveren en drinkbaar te maken (veilig om te drinken). Het wordt gebruikt bij de voorbehandeling van water dat later wordt gebotteld om te drinken of water dat zal worden gebruikt als ingrediënt bij de vervaardiging van dranken of frisdranken..

In de tandheelkunde
Het wordt gebruikt in de instrumenten die door de tandarts of tandarts worden gebruikt om ze te desinfecteren en pathogene organismen erin te vernietigen.
In medische toepassingen
Waterige oplossingen van ClOtwee zijn gebruikt om orale schimmelinfecties (infectie in de mond) te behandelen. Candidiasis is een infectie die wordt veroorzaakt door de schimmel Candida albicans.
Chloordioxide doodt mondschimmel en verbetert het uiterlijk van mondweefsel aanzienlijk zonder bijwerkingen.
Sommige medische onderzoekers geven aan dat ClO-oplossingentwee aangebracht op wonden van chirurgische ingrepen kan adhesievorming verminderen of onderdrukken zonder de genezing ervan te beïnvloeden, met als bijkomend voordeel zijn antiseptische eigenschappen.
Andere gebruiken
Vanwege zijn oxiderende en microbicide eigenschappen, ClOtwee is gebruikt voor:
- Maak pulp van hout wit bij de productie van pulp en papier, voor een stabiele glans.
- Bleken van vetten en oliën, leer, bleekmeel en textiel.
- Agrarische toepassingen zoals het desinfecteren van harde oppervlakken, apparatuur, watersystemen en champignonkassen.
- Toepassingen in industrieën, winkels en ziekenhuizen zoals het desinfecteren van harde oppervlakken (muren, vloeren, badkamers), ventilatiesystemen, laboratoriumapparatuur.
- Desinfecteer vloeren en badkamers van huizen, airconditioningsystemen, circulatiesystemen voor zwembadwater.
- Gemeentelijke en industriële afvalwaterzuivering.
- Olieveld vervuiling opruimen.
- Vervaardiging van chloridezouten (Cl-.
Risico's
- De geconcentreerde dampen van ClOtwee potentieel explosief zijn.
- Het is giftig bij inademing en inslikken. Het is irriterend voor de ogen, neus en keel, kan longoedeem en chronische bronchitis veroorzaken.
- Volgens de geraadpleegde bronnen is de ClOtwee veroorzaakt geen DNA-mutaties en veroorzaakt geen kanker bij mensen.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Chloordioxide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Dean, J.A. (editor). (1973). Lange's Handbook of Chemistry (elfde editie). McGraw-Hill Book Company.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Vijfde editie. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Bajpai, P. (2012). Bleken met chloordioxide. Effect van bleken met chloordioxide op de pulpkwaliteit. In milieuvriendelijke benaderingen voor het bleken van pulp (tweede editie). Opgehaald van sciencedirect.com.
- Moran, S. (2018). Waterchemie. Chloordioxide. In een toegepaste gids voor het ontwerp van water- en afvalwaterzuiveringsinstallaties. Opgehaald van sciencedirect.com.
- McKeen, L. (2012). Inleiding tot voedselbestraling en medische sterilisatie. Gasvormig chloordioxide. In het effect van sterilisatie op kunststoffen en elastomeren (derde editie). Opgehaald van sciencedirect.com.


Niemand heeft nog op dit artikel gereageerd.