
Domein SH2 kenmerken, structuur en functies
De SH2-domein Src Homology 2) is een sterk geconserveerd eiwitdomein in evolutie en aanwezig in meer dan 100 verschillende eiwitten, de meest prominente is het src-oncoproteïne, betrokken bij het signaaltransductieproces in de cel.
De functie van het domein is het binden aan gefosforyleerde tyrosine-sequenties op doeleiwitten; Deze vereniging triggert een reeks signalen die de expressie van genen reguleren. Dit domein is ook gevonden in het enzym tyrosinefosfatase.
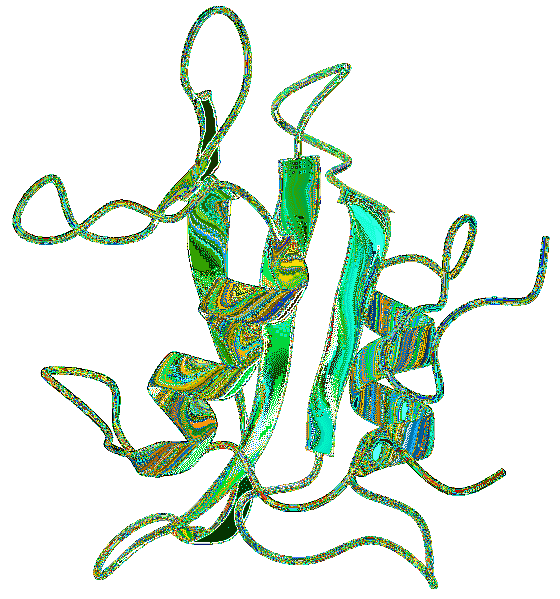
SH2-domeinen worden over het algemeen samen met andere domeinen aangetroffen die zijn geassocieerd met signaaltransductieroutes. Een van de meest voorkomende interacties is de verbinding met het SH2- en SH3-domein, dat betrokken lijkt te zijn bij het reguleren van de interactie met sequenties die rijk zijn aan proline..
Eiwitten kunnen een enkel SH2-domein of meer dan één bevatten, zoals het GAP-eiwit en de p85-subeenheid van fosfoinositol 3-kinasen..
Het SH2-domein is uitgebreid bestudeerd door de farmaceutische industrie om geneesmiddelen te produceren ter bestrijding van onder meer kanker, allergieën, auto-immuunziekten, astma, aids en osteoporose..
Artikel index
- 1 Kenmerken
- 2 Structuur
- 3 functies
- 4 Evolutie
- 5 Klinische implicaties
- 5.1 X-gebonden lymfoproliferatief
- 5.2 X-gebonden agammaglobulinemie
- 5.3 Noonan-syndroom
- 6 referenties
Kenmerken
Het SH2-domein bestaat uit ongeveer 100 aminozuren die zijn verbonden met katalytische domeinen. Het meest voor de hand liggende voorbeeld zijn tyrosinekinase-enzymen, die verantwoordelijk zijn voor het katalyseren van de overdracht van een fosfaatgroep van ATP naar tyrosine-aminozuurresiduen..
Verder zijn SH2-domeinen gerapporteerd in niet-katalytische domeinen zoals crk, grb2 / sem5 en nck..
SH2-domeinen zijn aanwezig in hogere eukaryoten en er is gesuggereerd dat ze ook in gist voorkomen. Met betrekking tot bacteriën, in Escherichia coli er is een module gerapporteerd die SH2-domeinen eraan herinnert.
Het src-eiwit is het eerste tyrosinekinase dat is ontdekt, dat, wanneer het gemuteerd is, waarschijnlijk betrokken is bij de regulering van de kinaseactiviteit en ook bij het bevorderen van de interacties van deze eiwitten met andere componenten in de cel..
Na de ontdekking van de domeinen in het scr-eiwit, werd het SH2-domein geïdentificeerd in een aanzienlijk aantal zeer gevarieerde eiwitten, waaronder eiwit-tyrosinekinasen en transcriptiefactoren..
Structuur
De structuur van het SH2-domein werd onthuld door het gebruik van technieken zoals röntgendiffractie, kristallografie en NMR (nucleaire magnetische resonantie), waarbij gemeenschappelijke patronen werden gevonden in de secundaire structuur van de bestudeerde SH2-domeinen..
Het SH2-domein heeft vijf sterk geconserveerde motieven. Een generiek domein is samengesteld uit β-kernplaten met kleine aangrenzende delen van antiparallelle β-platen, geflankeerd door twee α-helixen..
Aminozuurresiduen aan één kant van het blad en in het αA N-terminale gebied zijn betrokken bij het coördineren van de binding van peptiden. De rest van de kenmerken van de eiwitten is echter nogal variabel tussen de bestudeerde domeinen..
In het terminale koolstofgedeelte wordt een isoleucineresidu op de derde positie aangetroffen en vormt een hydrofobe holte op het oppervlak van het SH2-domein..
Een belangrijk kenmerk is het bestaan van twee regio's met elk een bepaalde functie. Het gebied tussen de eerste α-helix en het β-blad is de herkenningsplaats voor fosfotyrosine.
Evenzo vormt het gebied tussen de β-plaat en de α-helix van de terminale koolstof een regio die verantwoordelijk is voor de interactie met de terminale koolstofresiduen van fosfotyrosine..
Kenmerken
De functie van het SH2-domein is de herkenning van de fosforyleringstoestand op de tyrosine-aminozuurresiduen. Dit fenomeen is cruciaal bij signaaltransductie, wanneer een molecuul buiten de cel wordt herkend door een receptor op het membraan en verwerkt in de cel..
Signaaltransductie is een uiterst belangrijke regulerende gebeurtenis, waarbij de cel reageert op veranderingen in zijn extracellulaire omgeving. Dit proces vindt plaats dankzij de transductie van externe signalen in bepaalde moleculaire boodschappers via het membraan..
Tyrosinefosforylering leidt tot de opeenvolgende activering van eiwit-eiwitinteracties, wat resulteert in een verandering in genexpressie of veranderde cellulaire respons.
Eiwitten die SH2-domeinen bevatten, zijn betrokken bij regulerende routes die verband houden met essentiële cellulaire processen, zoals herschikking van het cytoskelet, homeostase, immuunresponsen en ontwikkeling..
Evolutie
De aanwezigheid van het SH2-domein is gerapporteerd in het primitieve eencellige organisme Monosiga brevicollis. Aangenomen wordt dat dit domein is geëvolueerd als een onveranderlijke signaleringseenheid met het verschijnen van tyrosinefosforylering..
Er wordt gespeculeerd dat de voorouderlijke rangschikking van het domein diende om de kinasen naar hun substraten te leiden. Dus, met de toename in complexiteit in organismen, verwierven de SH2-domeinen nieuwe functies in de loop van de evolutie, zoals de allosterische regulatie van het katalytische domein van kinasen..
Klinische implicaties
X-gebonden lymfoproliferatief
Van sommige gemuteerde SH2-domeinen is vastgesteld dat ze ziekte veroorzaken. Mutaties in het SH2-domein in SAP veroorzaken X-gebonden lymfoproliferatieve ziekte, die een sterke toename van de gevoeligheid voor bepaalde virussen en dus een ongecontroleerde proliferatie van B-cellen veroorzaakt..
Proliferatie treedt op omdat de mutatie van de SH2-domeinen storingen veroorzaakt in de signaalroutes tussen B- en T-cellen, wat leidt tot virale infecties en ongecontroleerde groei van B-cellen. Deze ziekte heeft een hoog sterftecijfer..
X-gebonden agammaglobulinemie
Evenzo zijn strut-mutaties in het SH2-domein van Bruton's proteïnekinase verantwoordelijk voor een aandoening die agammaglobulinemie wordt genoemd..
Deze aandoening is X-gebonden, gekenmerkt door een tekort aan B-cellen en een duidelijke afname van de immunoglobulineniveaus..
Noonan-syndroom
Ten slotte zijn mutaties in het N-terminale gebied van het SH2-domein in het proteïne-tyrosinefosfatase 2 de oorzaak van het Noonan-syndroom..
Deze pathologie wordt voornamelijk gekenmerkt door hartaandoeningen, een kleine gestalte door langzamere groei en afwijkingen aan het gezicht en het skelet. Bovendien kan de aandoening in een kwart van de bestudeerde gevallen mentale en psychomotorische retardatie vertonen..
Referenties
- Berg, J. M., Stryer, L., en Tymoczko, J. L. (2007). Biochemie. Omgekeerd.
- Filippakopoulos, P., Müller, S., & Knapp, S. (2009). SH2-domeinen: modulatoren van niet-receptortyrosinekinase-activiteit. Huidige mening in structurele biologie, 19(6), 643-649.
- Kurochkina, N. (Ed.). (2015). Sh-domeinen: structuur, mechanismen en toepassingen. Springer.
- Sawyer, T. K. (1998). Src-homologie - 2 domeinen: structuur, mechanismen en medicijnontdekking. Peptide Science, 47(3), 243-261.
- Schlessinger, J. (1994). SH2 / SH3-signaleringseiwitten. Huidige mening over genetica en ontwikkeling, 4(1), 25-30.


Niemand heeft nog op dit artikel gereageerd.