
Gibbs-vrije energie-eenheden, hoe deze te berekenen, opgeloste oefeningen
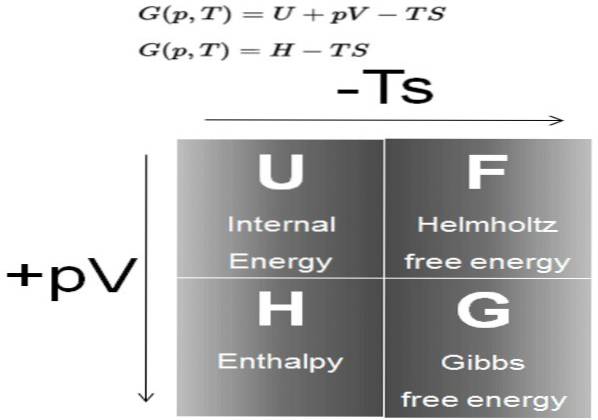
De Gibbs gratis energie (gewoonlijk G genoemd) is een thermodynamische potentiaal gedefinieerd als het verschil van de enthalpie H, minus het product van de temperatuur T, door de entropie S van het systeem:
G = H - TS
Gibbs-vrije energie wordt gemeten in joules (volgens het internationale systeem), in ergs (voor het Cegesimal-systeem van eenheden), in calorieën of in elektronvolt. (voor electro Volt).
In processen die plaatsvinden bij constante druk en temperatuur, is de variatie van Gibbs-vrije energie ΔG = ΔH - T ΔS. In dergelijke processen staat (G) voor de energie die in het systeem beschikbaar is en die kan worden omgezet in arbeid.
Bij exotherme chemische reacties neemt de enthalpie bijvoorbeeld af terwijl de entropie toeneemt. In de Gibbs-functie worden deze twee factoren tegengegaan, maar alleen wanneer de Gibbs-energie afneemt, vindt de reactie spontaan plaats..
Dus als de variatie van G negatief is, is het proces spontaan. Wanneer de Gibbs-functie zijn minimum bereikt, bereikt het systeem een stabiele evenwichtstoestand. Samenvattend kunnen we in een proces waarbij de druk en temperatuur constant blijven, bevestigen:
- Als het proces spontaan is, dan is ΔG < 0
- Als het systeem in evenwicht is: ΔG = 0
- In een niet-spontaan proces neemt G toe: ΔG> 0.
Artikel index
- 1 Hoe wordt het berekend?
- 1.1 - Stap voor stap
- 1.2 - Maxwell's thermodynamische relaties
- 2 Opgeloste oefeningen
- 2.1 Oefening 1
- 2.2 Oefening 2
- 2.3 Oefening 3
- 3 referenties
Hoe wordt het berekend?
De Gibbs-vrije energie (G) wordt berekend met behulp van de definitie die aan het begin is gegeven:
G = H - T⋅S
De enthalpie H is op zijn beurt een thermodynamisch potentieel dat wordt gedefinieerd als:
H = U + P V
- Stap voor stap
Vervolgens wordt een stapsgewijze analyse gemaakt om de onafhankelijke variabelen te kennen waarvan de Gibbs-energie een functie is:
1- Uit de eerste wet van de thermodynamica hebben we dat de interne energie U gerelateerd is aan de entropie S van het systeem en zijn volume V voor omkeerbare processen via de differentiële relatie:
dU = dQ - dW = TdS - PdV
Uit deze vergelijking volgt dat de interne energie U een functie is van de variabelen S en V:
U = U (S, V)
2- Vertrekkende van de definitie van H en het differentieel nemen, verkrijgen we:
dH = dU + d (P V) = dU + VdP + PdV
3- Vervanging van de uitdrukking voor dU verkregen in (1) hebben we:
dH = TdS - PdV + VdP + PdV = TdS + VdP
Hieruit wordt geconcludeerd dat de enthalpie H afhangt van de entropie S en de druk P, dat wil zeggen:
H = H (S, P)
4- Nu wordt het totale verschil in vrije energie van Gibbs berekend en wordt het volgende verkregen:
dG = dH -TdS -SdT = TdS + VdP -TdS -SdT
Waar dH is vervangen door de uitdrukking gevonden in (3).
5- Ten slotte krijgen we bij het vereenvoudigen: dG = VdP - SdT, duidelijk is dat de vrije energie G afhankelijk is van de druk en de temperatuur T als:
G = G (P, T)
- Maxwell's thermodynamische relaties
Uit de analyse in de vorige sectie volgt dat de interne energie van een systeem een functie is van entropie en volume:
U = U (S, V)
Dan is het verschil van OF zal zijn:
dU = ∂SU |V. dS + ∂V.U |S dV = TdS - PdV
Uit deze partiële afgeleide uitdrukking kunnen de zogenaamde Maxwell-thermodynamische relaties worden afgeleid. Gedeeltelijke afgeleiden zijn van toepassing wanneer een functie afhankelijk is van meer dan één variabele en gemakkelijk kunnen worden berekend door de stelling in de volgende sectie toe te passen.
Maxwell's eerste relatie
V.T |S = -SP |V.
Om tot deze relatie te komen, heeft de Stelling van Clairaut-Schwarz op partiële afgeleiden, waarin het volgende staat:
"De gemengde afgeleiden van de tweede orde met de verwisselde variabelen zijn gelijk, zolang de af te leiden functies continu en differentieerbaar zijn".
Maxwell's tweede relatie
Gebaseerd op wat wordt getoond in punt 3 van de vorige sectie:
H = H (S, P) en dH = TdS + VdP
Het kan worden verkregen:
P.T |S = SV |P.
We gaan op dezelfde manier te werk met Gibbs-vrije energie G = G (P, T) en met Helmholtz gratis energie F = F (T, V) om de andere twee thermodynamische relaties van Maxwell te verkrijgen.

Maxwell's vier thermodynamische relaties
1- Geassocieerd met de interne energie U: V.T |S = -SP |V.
2- Degene die is verkregen uit de enthalpie H: P.T |S = SV |P.
3- Gerelateerd aan de Helmholtz-energie F: TP |V. = V.S |T
4- Gekoppeld aan de vrije energie G van Gibbs: TV |P. = -P.S |T
Opgeloste oefeningen
Oefening 1
Bereken de variatie van de Gibbs-vrije energie voor 2 mol ideaal gas bij een temperatuur van 300K tijdens een isotherme expansie die het systeem van een initieel volume van 20 liter naar een eindvolume van 40 liter brengt.
Oplossing
Herinnerend aan de definitie van Gibbs-vrije energie hebben we:
G = H - TS
Dan is een eindige variatie van F:
ΔG = ΔH - T ΔS, aangezien ΔT = 0
In ideale gassen hangt de enthalpie alleen af van de absolute temperatuur, maar aangezien het een isotherm proces is, is ΔH = 0 en ΔG = - T ΔS.
Voor ideale gassen is de entropieverandering van een isotherm proces:
ΔS = nR ln (Vtwee/ V1
Dat gold voor het geval van deze oefening blijft:
ΔS = 2 mol x 8,314 J / (K mol) x ln (40L / 20L) = 11,53 J / K
Dan kunnen we de verandering in Helmholtz-energie krijgen:
ΔG = - 300K x 11,53 J / K = -3457,70 J.
Oefening 2
Rekening houdend met het feit dat de vrije energie van Gibbs een functie is van temperatuur en druk G = G (T, P); bepaal de variatie van G tijdens een proces waarin de temperatuur niet verandert (isotherm) voor n mol van een mono-atomair ideaal gas.
Oplossing
Zoals hierboven aangetoond, hangt de verandering in Gibbs-energie alleen af van de verandering in temperatuur T en volume V, dus een oneindig kleine variatie ervan wordt berekend volgens:
dG = -SdT + VdP
Maar als het een proces is waarbij de temperatuur constant is, dan is dF = + VdP, dus een eindige drukvariatie ΔP leidt tot een verandering in de Gibbs-energie die wordt gegeven door:
ΔG = + ∫ VdP = + ∫ (n R T) dP / P = + n R T ln (ΔP)
Met behulp van de ideale gasvergelijking:
P V = n R T
Tijdens een isotherm proces komt het voor dat:
d (P V) = P dV + V dP = 0
Dat is:
dP / P = - dV / V
Het bovenstaande resultaat kan dus worden geschreven als een functie van de volumevariatie AV
ΔG = + ∫ VdP = + ∫ (n R T) dP / P = - ∫ (n R T) dV / V = -n R T ln (ΔV)
Oefening 3
Gezien de volgende chemische reactie:
Ntwee0 (g) + (3/2) Otwee (g) ↔️ 2NOtwee (g) bij temperatuur T = 298 K
Zoek de variatie van de Gibbs-vrije energie en geef aan de hand van het verkregen resultaat aan of het een spontaan proces is of niet.
Oplossing
Hier zijn de stappen:
- Stap één: Enthalpies of Reaction
ΔHr = 2 * ΔH (NOtwee (g)) - ΔH (Ntwee0 (g)) = 2 * 33,2-81,6 = -15,2 kJ / mol
- Tweede stap: de variatie van reactie-entropie
ΔSr = 2 * S (GEENtwee (g)) - S (Ntwee0 (g)) - (3/2) S (Otwee (g)) = 2 * 240,1 - 220,1 - 1,5 * 205,2 = -47,7 J / (mol * K).
- Derde stap: variatie in de Gibbs-functie
Deze waarde bepaalt de balans tussen de afnemende energie en de toenemende entropie om te weten of de reactie uiteindelijk spontaan is of niet.
ΔGr = ΔHr - T ΔSr = -15,2 -298 * (- 47,7) = -985,4 J / mol
Aangezien het een negatieve variatie is van de Gibbs-energie, kan worden geconcludeerd dat het een spontane reactie is bij een temperatuur van 298 K = 25 ºC.
Referenties
- Kastanjes E. Gratis energieoefeningen. Hersteld van: lidiaconlaquimica.wordpress.com.
- Cengel, Y. 2012. Thermodynamica. 7e editie. Mcgraw heuvel.
- Libretexts. Gibbs gratis energie. Hersteld van: chem.libretexts.org
- Libretexts. Wat zijn gratis energieën. Hersteld van: chem.libretexts.org
- Wikipedia. Gibbs gratis energie. Hersteld van: es.wikipedia.com
- Wikipedia. Gibbs gratis energie. Hersteld van: en.wikipedia.com


Niemand heeft nog op dit artikel gereageerd.