
Humorale immuniteitstheorie, effectormechanismen, voorbeelden

De humorale immuniteit, ook bekend als de antilichaam-gemedieerde immuunrespons, het is een van de belangrijkste afweermechanismen van organismen tegen invasie door micro-organismen of extracellulaire toxines.
In het bijzonder verwijst humorale immuniteit naar immuniteit die wordt gemedieerd door bloedfactoren, die serumeiwitten zijn die bekend staan als "antilichamen" die functioneren in reacties op infecties en specifiek worden geproduceerd in reactie op de aanwezigheid van "antigenen"..
Het immuunsysteem van een zoogdier kan worden onderverdeeld in een aangeboren immuunsysteem en een adaptief immuunsysteem. Het aangeboren immuunsysteem bestaat uit de verschillende elementen die functioneren als fysieke en chemische barrières tegen het binnendringen van binnendringende stoffen in het lichaam..
Onder dergelijke barrières bevinden zich het epitheel en enkele van de stoffen die erdoor worden geproduceerd; er zijn ook enkele specifieke celtypen bij betrokken, die samen het eerste afweersysteem van het lichaam vertegenwoordigen.
Het adaptieve of specifieke immuunsysteem is iets complexer en "geëvolueerd", aangezien het wordt geactiveerd als reactie op blootstelling aan infectieuze agentia of door contact met bepaalde micro-organismen, hoewel beide systemen meestal samenwerken..
Er wordt gezegd dat het een specifiek systeem is omdat het optreedt als reactie op gedefinieerde determinanten en wordt gemedieerd door zeer gespecialiseerde cellen die ook het vermogen hebben om zich te 'herinneren' en sneller en met meer 'kracht' of 'efficiëntie' te reageren op herhaalde blootstelling aan dezelfde binnenvallende agent.
Humorale immuniteit is een van de subcategorieën van adaptieve of specifieke immuniteit, die ook wordt geclassificeerd onder cellulaire immuniteit. Beide soorten reacties verschillen van elkaar, afhankelijk van de component van het betrokken immuunsysteem..
Artikel index
- 1 Theorie
- 1.1 Een stukje geschiedenis
- 2 Effector mechanismen
- 2.1 Fasen van de humorale immuunrespons
- 2.2 Lymfocyten en antilichamen
- 2.3 Immunoglobulinen
- 2.4 Humorale immuunrespons
- 3 voorbeelden
- 4 referenties
Theorie
De theorie van humorale immuniteit, die het product was van jarenlang intensief onderzoek en debat, stelt voor dat immuniteit wordt gemedieerd door stoffen die aanwezig zijn in lichaamsvloeistoffen of 'humors'..
Deze theorie is ontwikkeld door veel wetenschappers, die onafhankelijk veel van de effectoren die bij dergelijke reactiemechanismen betrokken zijn, hebben bestudeerd en beschreven..
Paul Ehrlich was misschien wel een van de meest invloedrijke, aangezien hij in het begin van de 20e eeuw de meest diepgaande studies uitvoerde naar de complementariteit tussen antigeen en antilichaam..
Een beetje geschiedenis
De beroemde immunoloog Rudolph Virchow stelde in 1858 vast dat alle lichamelijke pathologieën te wijten waren aan het slecht functioneren van de cellulaire elementen die verantwoordelijk zijn voor bescherming, in plaats van aan een "verkeerde combinatie van de oplosbare lichaamsvochten"..
Iets meer dan 25 jaar later, in 1884, bracht Eli Metchnikoff de eerste publicatie aan het licht van de fagocytische theorie, die tegenwoordig de belangrijkste grondslagen vormt en ondersteunt van de theorie van celgemedieerde immuniteit (cellulaire immuniteit)..
Veel tegenstanders van Metchnikoff probeerden zijn beweringen te 'weerleggen' en het was in 1888 dat George Nuttall, die een reeks experimenten uitvoerde om de theorieën van Metchnikoff te testen, opmerkte dat het serum van normale dieren een 'natuurlijke toxiciteit' had tegen bepaalde micro-organismen..
Op deze manier werd het populair in de wetenschappelijke wereld dat celvrije vloeistoffen van “gezonde” of “speciaal geïmmuniseerde” dieren bacteriën konden doden, zodat het niet nodig was om naar celtheorie terug te grijpen om aangeboren en verworven immuniteit te verklaren..
De eersten die experimenteel het bestaan van een humorale immuunrespons verifieerden, waren Emil von Behring en Shibasaburo Kitasato in de late jaren 1800. Von Behring en Kitasato toonden aan dat de immuunresponsen die door difterie en tetanus werden opgewekt, te wijten waren aan de aanwezigheid van antilichamen tegen exotoxine..
In het begin van de 20e eeuw realiseerden Karl Landsteiner en andere onderzoekers zich dat andere gifstoffen en stoffen van niet-bacteriële oorsprong humorale immuniteit konden veroorzaken..
De term "antilichaam" werd kort daarna bedacht als een algemeenheid, om te verwijzen naar die specifieke stoffen die zouden kunnen functioneren als antitoxines tegen "antigenen".
Het woord antigeen was de term die werd gebruikt om de stoffen te definiëren die de productie van humorale antilichamen veroorzaken.
Effector mechanismen
Zowel humorale immuunresponsen als cellulaire immuunresponsen worden gemedieerd door een type cel dat bekend staat als lymfocyten..
De belangrijkste protagonisten van cellulaire immuniteit zijn T-lymfocyten, terwijl het B-lymfocyten zijn die reageren op de aanwezigheid van vreemde antigenen en de antilichaamproducerende cellen worden die kenmerkend zijn voor humorale immuniteit..
Humorale immuniteit is het belangrijkste afweermechanisme tegen extracellulaire micro-organismen en andere toxines, terwijl cellulaire immuniteit bijdraagt aan de eliminatie van intracellulaire pathogenen, die "niet toegankelijk" zijn voor herkenning door antilichamen..
Fasen van de humorale immuunrespons
Naast de cellulaire immuunrespons kan de humorale respons worden onderverdeeld in drie fasen: een van herkenning, een van activering en een van effect..
De herkenningsfase bestaat uit de binding van antigenen aan specifieke membraanreceptoren op het celoppervlak van rijpe B-lymfocyten..
Antilichamen functioneren als dergelijke "receptoren" en zijn in staat eiwitten, polysacchariden, lipiden en andere "vreemde" extracellulaire substanties te herkennen..
De activeringsfase begint met de proliferatie van lymfocyten na herkenning van antigenen en gaat verder met differentiatie, hetzij in andere effectorcellen die antigenen kunnen elimineren, hetzij in geheugencellen die snellere reacties kunnen opwekken na een nieuwe blootstelling eraan..
Tijdens de effectorfase staan de lymfocyten die antigeen-eliminatiefuncties uitoefenen bekend als "effectorcellen", hoewel gewoonlijk andere cellen deelnemen, die ook deelnemen aan de aangeboren immuunrespons, en die vreemde agentia fagocyteren en elimineren..
Lymfocyten en antilichamen
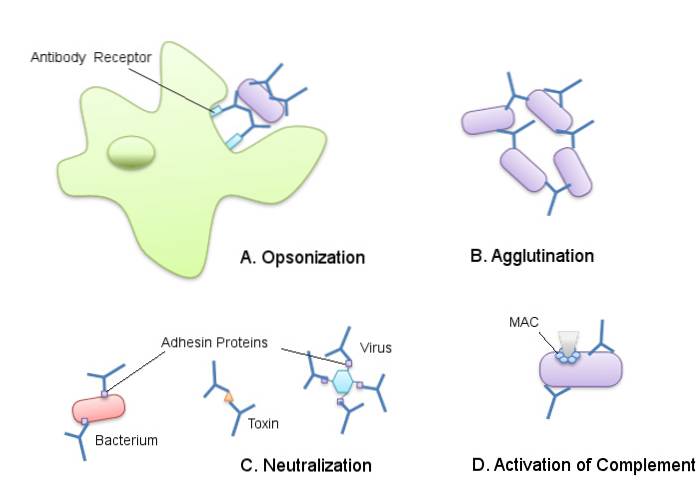
De antilichamen geproduceerd door lymfocyten of B-cellen hebben de fysiologische functie van het neutraliseren en elimineren van het antigeen dat hun vorming veroorzaakte en het humorale immuunsysteem kan reageren op een veelvoud van verschillende antigenen..
B-lymfocyten ontstaan in het beenmerg als reactie op een gedefinieerd antigeen (ze zijn specifiek) en dit gebeurt voorafgaand aan antigene stimulatie. Expressie van specifieke antilichamen veroorzaakt proliferatie- en differentiatiereacties van meer antilichaam-uitscheidende B-cellen.
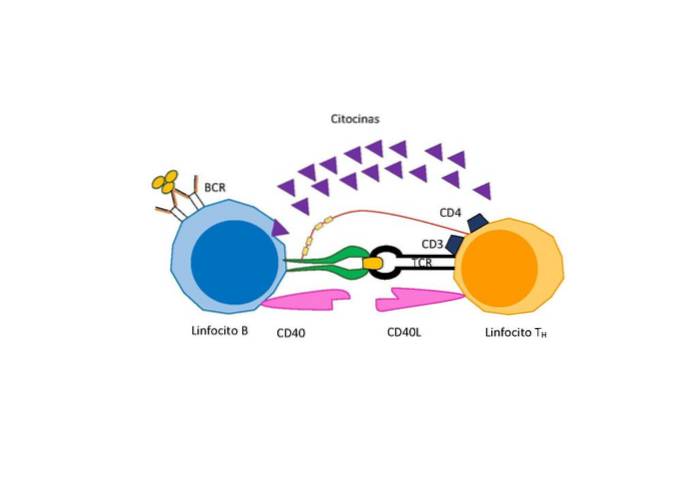
Afhankelijk van de aard van het antigeen is er echter een aanvullend signaal nodig voor differentiatie en proliferatie dat wordt afgegeven door een speciaal type T-lymfocyt genaamd "helper-T-lymfocyt" dat activerende factoren voor B-cellen uitscheidt..
Immunoglobulinen
Omdat ze voornamelijk in bloedvloeistoffen worden aangetroffen, worden de antilichamen die door B-cellen worden geproduceerd immunoglobulinen genoemd. Deze eiwitmoleculen hebben twee zware en twee lichte glycoproteïneketens die met elkaar zijn verbonden via disulfidebruggen (S-S)..
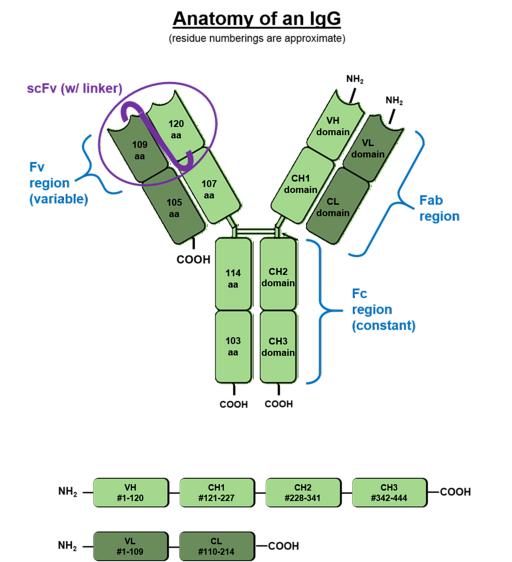
De lichte ketens staan bekend als "kappa" en "lambda", maar er zijn 5 soorten zware ketens die gamma (G), mu (M), alpha (A), delta (D) en epsilon (E) worden genoemd..
De combinatie van lichte en zware ketens eindigt met de vorming van de immunoglobulinen IgG, IgM, IgA, IgD en IgE. Het meest voorkomende antilichaam in zoogdierlijke serum tegen immunoglobuline IgG (ongeveer 70%).
Elke keten van een antilichaam heeft een amino-uiteinde en een carboxyl-uiteinde. Het deel dat aan antigenen kan binden, bevindt zich aan het amino-terminale uiteinde, maar het carboxyl-terminale gebied bepaalt de biologische activiteit.
Humorale immuunrespons
Het carboxyl-terminale gebied van IgG-antilichamen wordt specifiek herkend door fagocytische cellen zoals neutrofielen en macrofagen, die er speciale receptoren voor hebben..
Deze herkenning impliceert contact tussen de receptor en het antilichaam en het is deze vereniging die fagocytose en afbraak van antigenen in fagocytische cellen mogelijk maakt..
In tegenstelling tot IgG worden de andere klassen immunoglobulinen niet gevonden in secreties en weefsels. Ze zijn echter net zo nuttig bij het opwekken van de immuunrespons..
IgM-immunoglobulinen (10% van serumimmunoglobulinen) zijn krachtige activatoren van het complementsysteem, daarom werken ze bij de lysis van antigenen en verhogen ze de resistentie.
IgA-immunoglobulinen (20% van serum-immunoglobulinen) worden geproduceerd in lymfoïde weefsels en worden verwerkt en getransporteerd naar het longslijmvlies en het maagdarmkanaal. Deze werken bij de neutralisatie van virussen en andere antigenen die via slijmvliesoppervlakken binnendringen..
IgD is gebonden aan B-lymfocyten en functioneert als een antigeenreceptor, terwijl IgE (bekend als het allergische antilichaam) via specifieke receptoren aan het oppervlak van mestcellen en basofielen wordt gebonden. Beide immunoglobulinen zijn in zeer lage concentratie in serum.
Voorbeelden
De antilichamen geproduceerd door de belangrijkste effectoren van de humorale immuunrespons (B-lymfocyten) hebben het vermogen om verschillende responsmechanismen tegen verschillende soorten bedreigingen te "induceren" of "activeren"..
IgG-immunoglobulinen zijn bijvoorbeeld activatoren van wat bekend staat als de "complementcascade", die virale deeltjes neutraliseert en zo hun binding aan gastheercellen verhindert..
Tijdens de zwangerschap draagt de moeder antilichamen over aan de foetus via de trofoblastische cellen van de placenta, die receptoren hebben met een hoge affiniteit voor het carboxyluiteinde van immunoglobulinen zoals IgG..
De humorale reactie op bacteriën met "capsules" die uit polysacchariden bestaan, wordt gemedieerd door immunoglobuline M, dat fagocytose van deze micro-organismen bevordert..
Een ander belangrijk voorbeeld van humorale immuniteit is de systemische reactie op parasieten, waarbij IgE hun vernietiging "stuurt" door middel van eosinofiele cellen..
Referenties
- Abbas, A., Lichtman, A., & Pober, J. (1999). Cellulaire en moleculaire immunologie (3e ed.). Madrid: McGraw-Hill.
- Carroll, M. C., & Isenman, D. E. (2012). Regulering van humorale immuniteit door complement. Immuniteit, 37(2), 199-207.
- Kindt, T., Goldsby, R., & Osborne, B. (2007). Kuby's immunologie (6e ed.). México D.F.: McGraw-Hill Interamericana de España.
- Klein, T. (2007). De verworven immuunrespons. In xPharm: The Comprehensive Pharmacology Reference (blz. 1-5).
- Lishner, H., en DiGeorge, A. (1969). Rol van de thymus bij humorale immuniteit. The Lancet, twee, 1044-1049.
- Medzhitov, R., en Janeway, C. (2000). Aangeboren immuniteit. The New England Journal of Medicine, 338-344.
- Merlo, L. M. F., en Mandik-Nayak, L. (2013). Adaptieve immuniteit: B-cellen en antilichamen. In Immunotherapie bij kanker: immuunonderdrukking en tumorgroei: tweede editie (blz. 25-40).
- Silverstein, A. M. (1979). Geschiedenis van de immunologie. Cellulaire versus humorale immuniteit: determinanten en gevolgen van een epische 19e-eeuwse strijd. Cellulaire immunologie, 48(1), 208-221.
- Steinman, R. M. (2008). Aangeboren koppelen aan adaptieve immuniteit via dendritische cellen. In Aangeboren immuniteit voor longinfectie (blz. 101-113).
- Tan, T. T., en Coussens, L. M. (2007). Humorale immuniteit, ontsteking en kanker. Huidige mening in immunologie, 19(2), 209-216.
- Twigg, H. L. (2005). Humorale immuunafweer (antilichamen): recente vorderingen. Proceedings of the American Thoracic Society, twee(5), 417-421.
- Wherry, E. J., en Masopust, D. (2016). Adaptieve immuniteit: neutraliseren, elimineren en onthouden voor de volgende keer. In Virale pathogenese: van basis tot systeembiologie: derde editie (blz. 57-69).


Niemand heeft nog op dit artikel gereageerd.