
Ethaanstructuur, eigenschappen, gebruik en risico's
De ethaan is een eenvoudige koolwaterstof met formule CtweeH.6 met een kleurloos en reukloos aardgas dat een zeer waardevolle en gediversifieerde toepassing heeft bij de synthese van ethyleen. Bovendien is het een van de aardse gassen die ook op andere planeten en stellaire lichamen rond het zonnestelsel zijn gedetecteerd. Het werd in 1834 ontdekt door wetenschapper Michael Faraday.
Onder het grote aantal organische verbindingen gevormd door koolstof- en waterstofatomen (bekend als koolwaterstoffen), zijn er verbindingen die in een gasvormige toestand zijn bij omgevingstemperaturen en -drukken, die op grote schaal worden gebruikt in tal van industrieën..
Deze zijn meestal afkomstig van het gasmengsel dat "aardgas" wordt genoemd, een product van hoge waarde voor de mensheid, en vormen onder andere alkanen van het type methaan, ethaan, propaan en butaan; ingedeeld volgens het aantal koolstofatomen in de keten.
Artikel index
- 1 Chemische structuur
- 1.1 Synthese van ethaan
- 2 Eigenschappen
- 2.1 Oplosbaarheid van ethaan
- 2.2 Kristallisatie van ethaan
- 2.3 Verbranding van ethaan
- 2.4 Ethaan in de atmosfeer en in hemellichamen
- 3 toepassingen
- 3.1 Ethyleenproductie
- 3.2 Basische chemische vorming
- 3.3 Koudemiddel
- 4 Risico's van ethaan
- 5 referenties
Chemische structuur
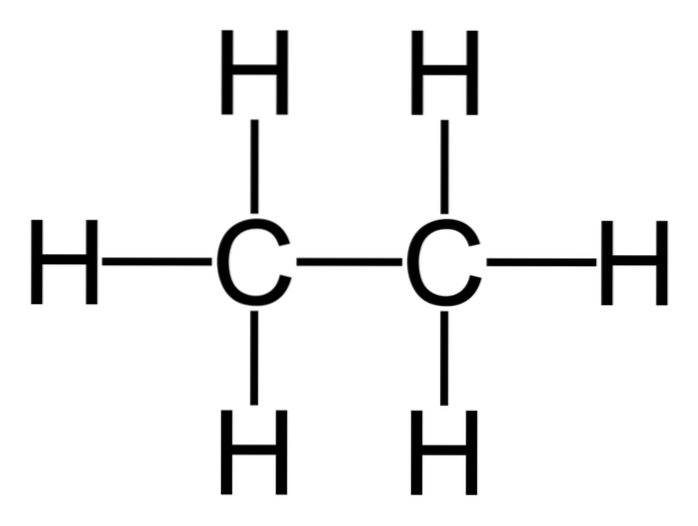
Ethaan is een molecuul met formule CtweeH.6, typisch gezien als een vereniging van twee methylgroepen (-CH3) om de koolwaterstof van een enkele koolstof-koolstofbinding te vormen. Het is ook de eenvoudigste organische verbinding na methaan, als volgt weergegeven:
H.3C-CH3
De koolstofatomen in dit molecuul hebben een sp-type hybridisatie3, dus de moleculaire bindingen vertonen vrije rotatie.
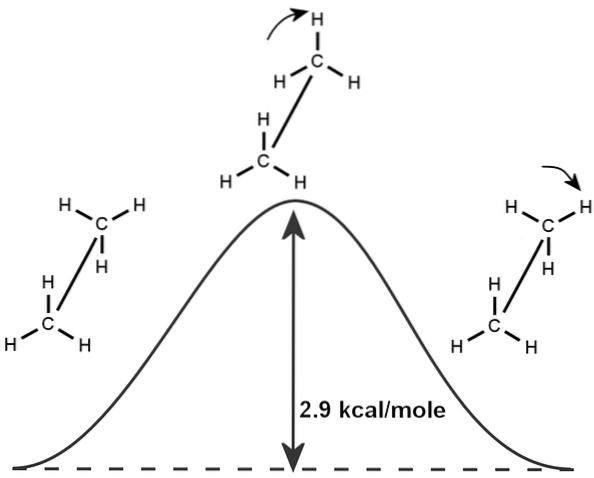
Evenzo is er een intrinsiek fenomeen van ethaan, dat is gebaseerd op de rotatie van de moleculaire structuur en de minimale energie die nodig is om een bindingsrotatie van 360 graden te produceren, die wetenschappers de 'ethaanbarrière' hebben genoemd..
Om deze reden kan ethaan in verschillende configuraties voorkomen, afhankelijk van de rotatie, hoewel de meest stabiele conformatie bestaat waar de waterstofatomen tegenover elkaar zijn (zoals te zien in de afbeelding).
Synthese van ethaan
Ethaan kan gemakkelijk worden gesynthetiseerd uit Kolbe-elektrolyse, een organische reactie waarin twee stappen plaatsvinden: een elektrochemische decarboxylering (verwijdering van de carboxylgroep en afgifte van kooldioxide) van twee carbonzuren, en de combinatie van de tussenproducten van het product om een covalente binding te vormen.
Evenzo leidt de elektrolyse van azijnzuur tot de vorming van ethaan en kooldioxide, en deze reactie wordt gebruikt om de eerste te synthetiseren..
De oxidatie van azijnzuuranhydride door de werking van peroxiden, een concept vergelijkbaar met dat van Kolbe's elektrolyse, resulteert ook in de vorming van ethaan..
Op dezelfde manier kan het efficiënt worden gescheiden van aardgas en methaan door een vloeibaarmakingsproces, waarbij gebruik wordt gemaakt van cryogene systemen om dit gas op te vangen en te scheiden van mengsels met andere gassen..
Het turbo-expansieproces heeft de voorkeur voor deze rol: het gasmengsel wordt door een turbine geleid, waardoor een expansie wordt gegenereerd, totdat de temperatuur onder de -100 ºC daalt.
Reeds op dit punt kunnen de componenten van het mengsel worden gedifferentieerd, zodat het vloeibare ethaan wordt gescheiden van het gasvormige methaan en de andere soorten die betrokken zijn bij het gebruik van een destillatie.
Eigendommen
Ethaan komt in de natuur voor als een geurloos en kleurloos gas bij standaard drukken en temperaturen (1 atm en 25 ° C). Het heeft een kookpunt van -88,5 ºC en een smeltpunt van -182,8 ºC. Het wordt ook niet beïnvloed door blootstelling aan sterke zuren of basen..
Oplosbaarheid in ethaan
Ethaanmoleculen zijn symmetrisch van configuratie en hebben zwakke aantrekkingskrachten die ze bij elkaar houden, de zogenaamde dispersiekrachten..
Wanneer ethaan wordt geprobeerd op te lossen in water, zijn de aantrekkende krachten tussen gas en vloeistof erg zwak, dus het is erg moeilijk voor ethaan om te binden met watermoleculen..
Om deze reden is de oplosbaarheid van ethaan aanzienlijk laag en neemt lichtjes toe wanneer de systeemdruk wordt verhoogd..
Ethaan kristallisatie
Ethaan kan worden gestold, wat resulteert in de vorming van onstabiele ethaankristallen met een kubische kristallijne structuur..
Met een temperatuurdaling van meer dan -183,2 ºC wordt deze structuur monoklien, waardoor de stabiliteit van het molecuul toeneemt.
Ethaanverbranding
Deze koolwaterstof kan, hoewel hij niet algemeen als brandstof wordt gebruikt, in verbrandingsprocessen worden gebruikt om kooldioxide, water en warmte op te wekken, wat als volgt wordt weergegeven:
2 CtweeH.6 + 7Otwee → 4COtwee + 6HtweeO + 3120 kJ
Het is ook mogelijk om dit molecuul te verbranden zonder overtollige zuurstof, wat bekend staat als "onvolledige verbranding", en wat resulteert in de vorming van amorfe koolstof en koolmonoxide in een ongewenste reactie, afhankelijk van de hoeveelheid toegepaste zuurstof.:
2 CtweeH.6 + 3Otwee → 4C + 6HtweeO + warmte
2 CtweeH.6 + 4etwee → 2C + 2CO + 6HtweeO + warmte
2 CtweeH.6 + 5Otwee → 4CO + 6HtweeO + warmte
In dit gebied vindt verbranding plaats door een reeks vrije radicalenreacties, die zijn genummerd in honderden verschillende reacties. Bij onvolledige verbrandingsreacties kunnen bijvoorbeeld verbindingen zoals formaldehyde, aceetaldehyde, methaan, methanol en ethanol worden gevormd..
Dit hangt af van de omstandigheden waaronder de reactie plaatsvindt en de betrokken vrije radicalenreacties. Ethyleen kan ook worden gevormd bij hoge temperaturen (600-900 ° C), wat een zeer gewenst product is door de industrie..
Ethaan in de atmosfeer en in hemellichamen
Ethaan is in sporen aanwezig in de atmosfeer van planeet Aarde, en men vermoedt dat mensen erin geslaagd zijn deze concentratie te verdubbelen sinds ze industriële activiteiten begonnen uit te oefenen..
Wetenschappers denken dat een groot deel van de huidige aanwezigheid van ethaan in de atmosfeer het gevolg is van de verbranding van fossiele brandstoffen, hoewel de wereldwijde uitstoot van ethaan met bijna de helft is afgenomen sinds de productietechnologieën voor schaliegas zijn verbeterd (een aardgasbron)..
Deze soort wordt ook van nature geproduceerd door het effect van zonlicht op atmosferisch methaan, dat recombineert en een ethaanmolecuul vormt.
Vloeibaar ethaan komt voor op het oppervlak van Titan, een van de manen van Saturnus. Dit komt in grotere hoeveelheden voor in de Vid Flumina-rivier, die meer dan 400 kilometer naar een van zijn zeeën stroomt. Deze verbinding is ook aangetoond op kometen en op het oppervlak van Pluto.
Toepassingen
Ethyleenproductie
Het gebruik van ethaan is voornamelijk gebaseerd op de productie van ethyleen, het organische product dat het meest wordt gebruikt in de wereldproductie, via een proces dat bekend staat als dampfase-kraken..
Dit proces bestaat uit het leiden van een toevoer van ethaan verdund met stoom naar een oven, die het snel zonder zuurstof verhit..
De reactie vindt plaats bij een extreem hoge temperatuur (tussen 850 en 900 ° C), maar de verblijftijd (de tijd die het ethaan in de oven doorbrengt) moet kort zijn om de reactie effectief te laten zijn. Bij hogere temperaturen wordt meer ethyleen gegenereerd.
Basische chemische vorming
Ethaan is ook bestudeerd als een hoofdbestanddeel bij de vorming van basischemicaliën. Oxidatieve chlorering is een van de voorgestelde processen om vinylchloride (een bestanddeel van PVC) te verkrijgen, ter vervanging van andere, minder economische en gecompliceerde.
Koelmiddel
Ten slotte wordt ethaan gebruikt als koelmiddel in gangbare cryogene systemen, wat ook aantoont dat het mogelijk is om kleine monsters in het laboratorium in te vriezen voor analyse..
Het is een zeer goede vervanger voor water, dat meer tijd nodig heeft om delicate monsters af te koelen, en kan ook leiden tot de vorming van schadelijke ijskristallen..
Risico's van ethaan
-Ethaan heeft het vermogen om te ontbranden, vooral als het zich bindt met lucht. Bij 3,0 tot 12,5 vol.% Ethaan in lucht kan zich een explosief mengsel vormen.
-Het kan de zuurstof in de lucht waarin het wordt aangetroffen beperken, en daarom vormt het een risicofactor voor verstikking voor mensen en dieren die aanwezig en blootgesteld zijn.
-Ethaan in bevroren vloeibare vorm kan de huid ernstig verbranden als het er direct mee in contact komt, en het werkt ook als een cryogeen medium voor elk voorwerp dat het aanraakt, waardoor het onmiddellijk bevriest.
-Vloeibare ethaandampen zijn zwaarder dan lucht en concentreren zich op de grond, dit kan een risico op ontbranding opleveren dat een verbrandingskettingreactie kan veroorzaken.
-Inname van ethaan kan misselijkheid, braken en inwendige bloedingen veroorzaken. Inademing veroorzaakt naast verstikking ook hoofdpijn, verwarring en stemmingswisselingen. Dood door hartstilstand is mogelijk bij hoge blootstellingen.
-Het vertegenwoordigt een broeikasgas dat, samen met methaan en kooldioxide, bijdraagt aan de opwarming van de aarde en klimaatverandering veroorzaakt door menselijke vervuiling. Gelukkig is het minder overvloedig en duurzaam dan methaan en absorbeert het minder straling dan methaan..
Referenties
- Britannica, E. (s.f.). Ethaan. Opgehaald van britannica.com
- Nes, G. V. (s.f.). Monokristallijne structuren en elektronendichtheidsverdelingen van ethaan, ethyleen en acetyleen. Opgehaald van rug.nl
- Sites, G. (s.f.). Ethaan: bronnen en putten. Opgehaald van sites.google.com
- SoftSchools. (s.f.). Ethaan formule. Opgehaald van softschools.com
- Wikipedia. (s.f.). Ethaan. Opgehaald van en.wikipedia.org



Niemand heeft nog op dit artikel gereageerd.