
Eigenschappen, risico's en toepassingen van kaliumferrocyanide
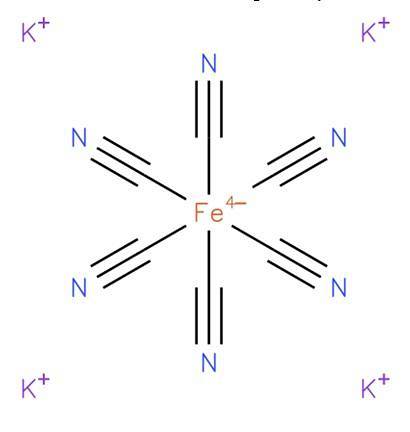
De kaliumferrocyanide, ook bekend als kaliumhexacyanoferraat (II) of Pruisisch geel, het is een anorganische verbinding met formule K4[Geloof (CN)6Het is een kaliumzout van het ferrocyanide-coördinatiecomplex (Fe (CN)64-) en is in het algemeen in de trihydraatvorm K4[Geloof (CN)6] · HtweeO. De structuur is weergegeven in figuur 1 (EMBL-EBI, 2008).
Historisch gezien werd het gemaakt van biologisch geproduceerde kooldioxidebronnen, ijzervijlsel en kaliumcarbonaat. Veelvoorkomende bronnen van stikstof en koolstof waren leerresten, slachtafval of gedroogd bloed.
Momenteel wordt kaliumferrocyanide industrieel geproduceerd uit waterstofcyanide, ferrochloride en calciumhydroxide, de combinatie hiervan geeft Catwee [Geloof (CN) 6] · 11HtweeOF.
Deze oplossing wordt vervolgens behandeld met kaliumzouten om het gemengde calcium-kalium CaK-zout neer te slaan.twee [Geloof (CN) 6], dat op zijn beurt wordt behandeld met kaliumcarbonaat om het tetrakaliumzout te geven.
Artikel index
- 1 Fysische en chemische eigenschappen
- 2 Reactiviteit en gevaren
- 2.1 Oogcontact
- 2.2 Huidcontact
- 2.3 Inademing
- 2.4 Inslikken
- 3 toepassingen
- 3.1 1- Voedingsmiddelenindustrie
- 3.2 2- Mijnbouw en metallurgie
- 3.3 3- Laboratoriumreagens
- 4 referenties
Fysische en chemische eigenschappen
Kaliumferrocyanide is een monoklien kristal met een gele of lichtgele kleur, afhankelijk van het hydratatieniveau, zonder een karakteristiek aroma (National Center for Biotechnology Information., 2017). Het uiterlijk wordt getoond in figuur 2 (Kaliumferrocyanide, 2017).

De verbinding heeft een molecuulgewicht van 368,35 g / mol voor de watervrije vorm en 422,388 g / mol voor de trihydraatvorm. Het heeft een dichtheid van 1,85 g / ml en een smeltpunt van 70 ° C waar het begint te ontbinden (Royal Society of Chemistry, 2015).
De verbinding is oplosbaar in water en kan 28,9 gram verbinding oplossen in 100 ml van dit oplosmiddel. Het is onoplosbaar in diethylether, ethanol en tolueen. De verbinding reageert op warmte om kaliumcyanide te vormen volgens de reactie:
K4[Geloof (CN)6] → 4 KCN + FeCtwee + Ntwee
In combinatie met geconcentreerde zuren vormt het waterstofcyanide (HCN), een zeer giftig, brandbaar gas dat explosieve mengsels kan vormen in lucht (Laffort, 2001).
Reactiviteit en gevaren
Kaliumferrocyanide is een stabiele verbinding, onverenigbaar met sterke zuren en oxidatiemiddelen. Kaliumferrocyanide is niet giftig en wordt in het lichaam niet afgebroken tot cyanide. De toxiciteit bij ratten is laag, met een dodelijke dosis (LD50) van 6400 mg / kg.
De stof is giftig voor de longen en slijmvliezen. De verbinding kan irritatie veroorzaken bij contact met huid en ogen..
Bij inslikken kan het irritatie van het maagdarmkanaal veroorzaken en bij inademing irritatie van het neusslijmvlies en het ademhalingssysteem..
Contact met de ogen kan leiden tot beschadiging van het hoornvlies of blindheid. Contact met de huid kan ontstekingen en blaren veroorzaken.
Inademing van stof veroorzaakt irritatie van het maagdarmkanaal of de luchtwegen, gekenmerkt door verbranding, niezen en hoesten. Ernstige overmatige blootstelling kan longschade, verstikking, bewusteloosheid of de dood veroorzaken..
Oogcontact
In geval van contact met de ogen, moeten de contactlenzen worden gecontroleerd en verwijderd. Ogen moeten onmiddellijk worden gespoeld met veel koud water gedurende tenminste 15 minuten.
Huidcontact
Het aangetaste gebied moet onmiddellijk worden gespoeld met veel water gedurende minstens 15 minuten, terwijl verontreinigde kleding en schoenen worden verwijderd. Bedek geïrriteerde huid met een verzachtend middel.
Was kleding en schoenen voordat u ze opnieuw gebruikt. Als het contact ernstig is, was dan met een desinfecterende zeep en bedek de besmette huid met een antibacteriële crème.
Inademing
Het slachtoffer moet naar een koele plaats worden verplaatst. Als het niet ademt, moet kunstmatige beademing worden gegeven. Bij ademhalingsmoeilijkheden zuurstof toedienen.
Inslikken
Als de verbinding wordt ingeslikt, mag braken niet worden opgewekt, tenzij voorgeschreven door medisch personeel. Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas.
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen (Veiligheidsinformatieblad Kaliumferrocyanide-trihydraat, 2013).
Toepassingen
1- Voedingsindustrie
Pruisisch geel staat ook bekend om het goedgekeurde Europese levensmiddelenadditiefnummer: E536 en kent diverse toepassingen in de voedingsindustrie. Het wordt gebruikt als antiklontermiddel voor zowel strooizout als keukenzout.
Het heeft ook een oenologisch gebruik om koper en ijzer bij de wijnbereiding te verwijderen. Koper wordt gebruikt als fungiciden in druiven (Wageningen University, 2014).
Het wordt ook gebruikt voor de fermentatie van citroenzuur (D.S. Clark, 1965). Kaliumferrocyanide kan ook worden gebruikt als meststof voor planten.
2- Mijnbouw en metallurgie
Kaliumferrocyanide wordt gebruikt om koper uit molybdeenmineralen te verwijderen. Het wordt ook gebruikt voor het cementeren van staal (Kaliumferrocyanide, K4Fe (CN) 6, 2012).
Cementeren is een thermochemische behandeling die wordt toegepast op stalen onderdelen. Het proces brengt koolstof naar de oppervlakte door diffusie, die wordt geïmpregneerd door de samenstelling ervan te wijzigen.
3- Laboratoriumreagens
Kaliumferrocyanide wordt gebruikt om de concentratie van kaliumpermanganaat te bepalen, een verbinding die vaak wordt gebruikt bij titraties op basis van redoxreacties..
Kaliumferrocyanide wordt gebruikt in een mengsel met kaliumferricyanide en fosfaatgebufferde oplossing om een buffer te bieden voor bèta-galactosidase, dat wordt gebruikt om X-Gal (5-broom-4-chloor-3-indolyl-β -D- galactopyranoside te splitsen, het geven van een helderblauwe visualisatie waarbij een antilichaam (of ander molecuul), geconjugeerd aan Beta-gal, aan zijn doelwit is gebonden.
De compound wordt ook gebruikt voor de productie van Pruisisch blauw. Bij reactie met Fe (III) geeft het een Pruisisch blauwe kleur, daarom wordt het gebruikt als identificatiereagens voor ijzer in laboratoria..
Het wordt ook gebruikt voor de bepaling van zink in zinksulfidemonsters. Het monster wordt opgelost in HCl 6N en kook onder een afzuigkap om waterstofsulfide te verwijderen, neutraliseer met ammoniumhydroxide en voeg 3 druppels HCl toe.
Verwarm tot koken en voeg 5 ml oplossing 1 toeN van kaliumferrocyanide. De aanwezigheid van een wit zinkferrocyanideprecipitaat duidt op een positieve test voor dit element (Mehlig, 1927).
Referenties
- S. Clark, K. I. (1965). Effect van kaliumferrocyanide op de chemische samenstelling van melasse-puree die wordt gebruikt bij de citroenzuurfermentatie. Biotechnologie en bio-engineering Volume 7, Issue 2, 269-278. Hersteld van onlinelibrary.wiley.com.
- EMBL-EBI. (2008, 16 januari). kaliumhexacyanoferraat (4−). Hersteld van ebi.ac.uk.
- (2001, 5 maart). KALIUMFERROCYANURE. Opgehaald van laffort.com.
- Veiligheidsinformatieblad Kaliumferrocyanide-trihydraat. (2013, 21 mei). Opgehaald van sciencelab.com.
- Mehlig, J. P. (1927). Gebruik van kaliumferrocyanide als bevestigingstest voor zink. Chem. Educ. 4 (6), 722. Opgehaald van pubs.acs.org.
- Nationaal centrum voor informatie over biotechnologie ... (2017, 15 april). PubChem samengestelde database; CID = 161067. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Kaliumferrocyanide. (2017, 25 maart). Opgehaald van sciencemadness.org.
- Kaliumferrocyanide, K4Fe (CN) 6. (2012). Opgehaald van atomistry.com.
- Royal Society of Chemistry. (2015). kaliumferrocyanide. Opgehaald van chemspider.com.
- Wageningen Universiteit. (2014, 14 augustus). E536: Kaliumferrocyanide. Opgehaald van food-info.net.



Niemand heeft nog op dit artikel gereageerd.