
Magnesiumfluoridestructuur, eigenschappen, synthese, gebruik
De magnesiumfluoride het is een kleurloos anorganisch zout waarvan de chemische formule MgF₂ is. Het wordt in de natuur aangetroffen als het mineraal sellaiet. Het heeft een zeer hoog smeltpunt en is zeer slecht oplosbaar in water. Het is relatief inert, omdat het bijvoorbeeld langzaam en onvolledig reageert met zwavelzuur en het bestand is tegen hydrolyse met fluorwaterstofzuur (HF) tot 750 ° C..
Het is een verbinding die weinig wordt beïnvloed door straling met hoge energie. Bovendien heeft het een lage brekingsindex, hoge corrosiebestendigheid, goede thermische stabiliteit, aanzienlijke hardheid en uitstekende zichtbare, UV- (ultraviolet) en IR- (infrarood) lichttransmissie-eigenschappen..
Deze eigenschappen zorgen ervoor dat het uitstekende prestaties levert op optisch gebied en bovendien een nuttig materiaal is als katalysatordrager, coatingselement, antireflecterende lenzen en vensters voor infraroodtransmissie, naast andere toepassingen..
Artikel index
- 1 Structuur
- 2 Eigenschappen
- 3 Synthese en voorbereiding
- 4 toepassingen
- 4.1 Optiek
- 4.2 Katalyse of versnelling van reacties
- 4.3 Andere toepassingen
- 5 referenties
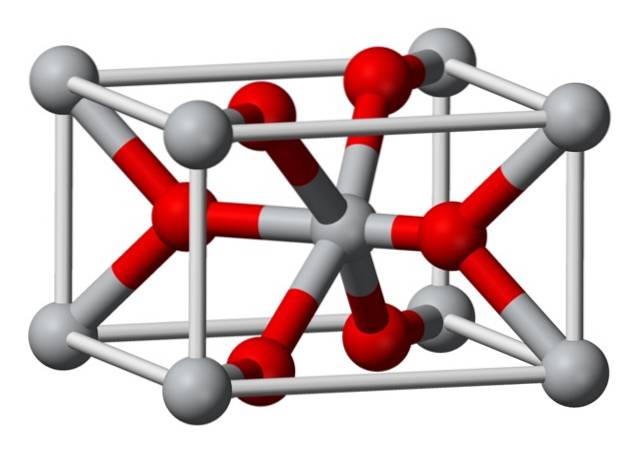
Structuur
De kristallijne structuur van chemisch bereid magnesiumfluoride is van hetzelfde type als die van het natuurlijke mineraal sellaiet. Kristalliseert in de dipyramidale klasse van het tetragonale systeem.
Magnesiumionen (Mg2 +) bevinden zich in een gecentreerde tetragonale roosterruimte, terwijl fluoride-ionen (F-) worden gevonden in hetzelfde vlak als en geassocieerd met hun Mg2 + buren, gegroepeerd in paren met elkaar. De afstand tussen de Mg2 + en F- ionen is 2,07 Å (ångström) (2,07 x 10-10 m).
De kristalcoördinatie is 6: 3. Dit betekent dat elk Mg2 + -ion is omgeven door 6 F-ionen en elk F-ion op zijn beurt is omgeven door 3 Mg2 + 5-ionen..
De structuur lijkt sterk op die van het mineraal rutiel, de natuurlijke vorm van titaandioxide (TiO2), waarmee het verschillende kristallografische eigenschappen gemeen heeft..
Tijdens de productie slaat magnesiumfluoride niet neer als een amorfe vaste stof, omdat de Mg2 + en F-ionen niet de neiging hebben om polymere complexen in oplossing te vormen..
Eigendommen
Interessant is dat magnesiumfluoride een dubbelbrekend materiaal is. Dit is een optische eigenschap waarmee een invallende lichtstraal kan worden opgesplitst in twee afzonderlijke stralen die zich voortplanten met verschillende snelheden en golflengten..
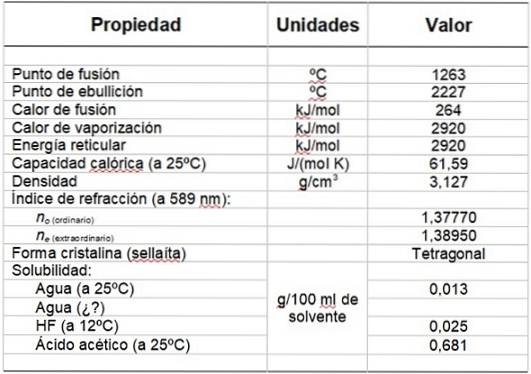
Tabel 1 toont enkele van zijn eigenschappen.
Tabel 1. Fysische en chemische eigenschappen van magnesiumfluoride.
Synthese en voorbereiding
Het kan op verschillende manieren worden bereid, waaronder de volgende:
1-Door de reactie tussen magnesiumoxide (MgO) of magnesiumcarbonaat (MgCO3) met fluorwaterstofzuur (HF) 2:
MgO + 2 HF MgF2 + H2O
MgCO3 + 2 HF MgF2 + CO2 + H2O
2-Door reactie tussen magnesiumcarbonaat en ammoniumbifluoride (NH4HF2), beide in vaste toestand, bij een temperatuur tussen 150 en 400ºC2:
150-400 ºC
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H2O
3-Verwarmen van een waterige oplossing van magnesiumcarbonaat en ammoniumfluoride (NH4F) in aanwezigheid van ammoniumhydroxide (NH4OH) bij 60ºC 2:
60 ° C, NH40H
MgCO3 + 3 NH4F NH4MgF3 + (NH4) 2CO3
Het resulterende neerslag van magnesiumammoniumfluoride (NH4MgF3) wordt vervolgens gedurende 4 uur verwarmd op 620 ° C om magnesiumfluoride te verkrijgen:
620 ºC
NH4MgF3 MgF2 + NH3 + HF
4-Als bijproduct van het verkrijgen van beryllium (Be) en uranium (U). Het fluoride van het gewenste element wordt verwarmd met metallisch magnesium in een smeltkroes bedekt met MgF2 2:
BeF2 + Mg Be + MgF2
5-Reagerend magnesiumchloride (MgCl2) met ammoniumfluoride (NH4F) in waterige oplossing bij kamertemperatuur 3:
25 ° C, H20
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Omdat de bereidingsmethoden voor MgF2 duur zijn, worden er pogingen ondernomen om het op een meer economische manier te verkrijgen, waarbij de methode om het te produceren uitgaande van zeewater opvalt..
Dit wordt gekenmerkt door het toevoegen van een voldoende hoeveelheid fluoride-ionen (F-) aan zeewater, dat een overvloedige concentratie aan magnesiumionen (Mg2 +) heeft, waardoor het neerslaan van MgF2 wordt bevorderd..
Optische kristallen van magnesiumfluoride worden verkregen door warmpersen van hoogwaardig MgF2-poeder, bijvoorbeeld verkregen volgens de NH4HF2-methode.
Er zijn veel technieken voor het bereiden van magnesiumfluoridematerialen, zoals eenkristalgroei, sinteren (verdichten tot vormen of vormen) zonder druk, heet persen en microgolfsinteren..
Toepassingen
Optiek
MgF2-kristallen zijn geschikt voor optische toepassingen omdat ze transparant zijn van het UV-gebied tot het middelste IR-gebied 2.10.
Als inerte film wordt het gebruikt om de lichttransmissie-eigenschappen van optische en elektronische materialen te veranderen. Een van de belangrijkste toepassingen is in VUV-optica voor ruimteverkenningstechnologie.
Vanwege zijn dubbele brekingseigenschap is dit materiaal nuttig in polarisatie-optica, in vensters en prisma's van de excimerlaser (een type ultraviolette laser dat wordt gebruikt bij oogchirurgie)..
Opgemerkt moet worden dat het magnesiumfluoride dat wordt gebruikt bij de vervaardiging van optische dunnefilmmaterialen vrij moet zijn van onzuiverheden of verbindingen die een bron van oxide zijn, zoals water (H2O), hydroxide-ionen (OH-), carbonaationen (CO3 = ), sulfaationen (SO4 =) en dergelijke 12.
Katalyse of versnelling van reacties
MgF2 is met succes gebruikt als katalysatorondersteuning voor de reactie van eliminatie van chloor en toevoeging van waterstof in CFK's (chloorfluorkoolwaterstoffen), bekende koelmiddelen en drijfgassen in spuitbussen, en verantwoordelijk voor de schade aan de ozonlaag van de atmosfeer.
De resulterende verbindingen, HFK (fluorkoolwaterstoffen) en HCFK (chloorfluorkoolwaterstoffen), hebben dit schadelijke effect niet op de atmosfeer 5.
Het is ook nuttig geweest als katalysatordrager voor de hydro-ontzwaveling (verwijdering van zwavel) van organische verbindingen..
Andere gebruiken
De materialen die worden gegenereerd door de intercalatie van grafiet, fluor en MgF2 hebben een hoge elektrische geleidbaarheid, en daarom zijn ze voorgesteld voor gebruik in kathodes en als elektrisch geleidende materialen..
Het eutecticum gevormd door NaF en MgF2 heeft energieopslageigenschappen in de vorm van latente warmte, en daarom is overwogen voor gebruik in zonne-energiesystemen..
Op het gebied van biochemie wordt magnesiumfluoride, samen met andere metaalfluoriden, gebruikt om fosforyloverdrachtsreacties in enzymen te remmen.
Onlangs zijn MgF2-nanodeeltjes met succes getest als vectoren voor medicijnafgifte in zieke cellen voor de behandeling van kanker..
Referenties
- Buckley, H.E. en Vernon, W.S. (1925) XCIV. De kristalstructuur van magnesiumfluoride. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, Volume 11, Fifth Edition, John Wiley & Sons. ISBN 0-471-52680-0 (v.11).
- Peng, Minhong; Cao, Weiping; en Song, Jinhong. (2015). Bereiding van MgF2 doorschijnend keramiek door warmpersen sinteren. Journal of Wuhan University of Technology-Mater: Sci. Ed. Vol. 30 nr. 4.
- Непоклонов, И.С. (2011). Magnesiumfluoride. Bron: eigen werk.
- Wojciechowska, Maria; Zielinski, Michal; en Pietrowski, Mariusz. (2003). MgF2 als een niet-conventionele katalysatordrager. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Magnesiumfluoride (MgF2). Ontvangen 2019/07/12 op: korth.de
- Sevonkaev, Igor en Matijevic, Egon. (2009). Vorming van magnesiumfluoridedeeltjes met verschillende morfologieën. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Magnesiumfluoride. Bron: eigen werk.
- Tao Qin, Peng Zhang en Weiwei Qin. (2017). Een nieuwe methode om goedkope magnesiumfluoridesferen uit zeewater te synthetiseren. Ceramics International 43 (2017) 14481-14483.
- Ullmann's Encyclopedia of Industrial Chemistry (1996) Vijfde editie. Jaargang A11. VCH Verlagsgesellschaft mbH. New York. ISBN 0-89573-161-4.
- NASA (2013). Ingenieurs inspecteren de primaire spiegel 8109563 van de Hubble-ruimtetelescoop. Bron: mix.msfc.nasa.gov



Niemand heeft nog op dit artikel gereageerd.