
Aluminiumfosfide (AIP) structuur, eigenschappen, gebruik, risico's
De aluminiumfosfide Het is een anorganische verbinding gevormd door een aluminiumatoom (Al) en een fosforatoom (P). De chemische formule is AlP. Het is een effen donkergrijs of, als het erg puur is, geel. Het is een uiterst giftige stof voor levende wezens.
Aluminiumfosfide reageert met vocht om fosfine of fosfaan PH te vormen3, dat is een giftig gas. Om deze reden mag AlP niet in contact komen met water. Reageert sterk met zuren en logen.

Het werd in het verleden gebruikt om ongedierte zoals insecten en knaagdieren te elimineren op plaatsen waar graankorrels en andere landbouwproducten werden opgeslagen. Vanwege het grote gevaar is het echter in de meeste landen van de wereld verboden..
Momenteel wordt het nut ervan op het gebied van elektronica theoretisch onderzocht met behulp van computers die de mogelijkheid berekenen om halfgeleider-AlP-nanobuisjes te verkrijgen, dat wil zeggen extreem kleine buisjes die alleen onder bepaalde omstandigheden elektriciteit kunnen doorgeven..
Aluminiumfosfide is een zeer gevaarlijke verbinding, het moet worden gehanteerd met veiligheidsuitrusting zoals handschoenen, bril, gasmaskers en beschermende kleding..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Dichtheid
- 3.5 Oplosbaarheid
- 3.6 Chemische eigenschappen
- 3.7 Overige eigendommen
- 4 Verkrijgen
- 5 toepassingen
- 5.1 Bij ongediertebestrijding (stopgezet gebruik)
- 5.2 In andere toepassingen
- 6 Theoretisch onderzoek van AlP-nanobuisjes
- 6.1 AlP-nanobuisjes met boor
- 6.2 AlP-nanobuisjes met gewijzigde structuur
- 7 Risico's
- 8 referenties
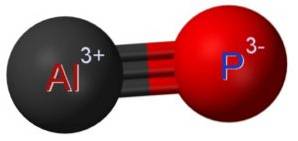
Structuur
Het aluminiumfosfide AlP wordt gevormd door de vereniging van een aluminiumatoom Al en een fosforatoom P. De binding tussen beide is covalent en drievoudig, daarom is het erg sterk.
Aluminium in AlP heeft een oxidatietoestand van +3 en fosfor heeft een valentie van -3.
Nomenclatuur
- Aluminiumfosfide
Eigendommen
Fysieke toestand
Donkergrijze of donkergele of groene kristallijne vaste stof. Kubieke kristallen.
Molecuulgewicht
57,9553 g / mol
Smeltpunt
2550 ºC
Dichtheid
2,40 g / cm3 bij 25 ° C
Oplosbaarheid
Ontleedt in water.
Chemische eigenschappen
Reageert met vocht en geeft fosfine of fosfaan PH3 dat is een brandbare en giftige verbinding. Fosfine of fosfaan ontbrandt spontaan bij contact met lucht, behalve als er overtollig water aanwezig is.
De reactie van aluminiumfosfide met water is als volgt:
Aluminiumfosfide + water → Aluminiumhydroxide + fosfine
AlP + 3 HtweeO → Al (OH)3 + PH3
De commerciële presentaties hebben aluminiumcarbonaat Altwee(CO33 om zelfontbranding van fosfine te voorkomen die optreedt wanneer AlP in contact komt met vocht in de lucht.
AlP is stabiel als het droog is. Reageert heftig met zuren en logen.
Aluminiumfosfide AlP smelt niet, sublimeert of ontleedt niet thermisch bij temperaturen zo hoog als 1000 ° C. Zelfs bij deze temperatuur is de dampspanning erg laag, dat wil zeggen dat het bij die temperatuur niet verdampt..
Bij verhitting tot ontbinding geeft het giftige fosforoxiden af. In contact met metalen kan het brandbare waterstofgassen uitstoten Htwee.
Andere eigenschappen
Wanneer het zuiver is, vertoont het een gelige kleur, wanneer het wordt gemengd met residuen van de bereidingsreactie vertoont het een kleur van grijs naar zwart..
De lage vluchtigheid zorgt ervoor dat het geen geur heeft, dus de knoflookgeur die het soms afgeeft, is te wijten aan fosfine PH3 die zich vormt in aanwezigheid van vocht.
Het verkrijgen van
Aluminiumfosfide kan worden verkregen door een mengsel van poedervormig aluminiummetaal (Al) en het rode fosfor (P) -element te verhitten.
Vanwege de affiniteit van fosfor (P) voor zuurstof (Otwee) en die van aluminium (Al) door zuurstof en stikstof (Ntwee), moet de reactie worden uitgevoerd in een atmosfeer die vrij is van deze gassen, bijvoorbeeld in een atmosfeer van waterstof (H.twee) of aardgas.
De reactie wordt gestart door een zone van het mengsel snel te verwarmen totdat de reactie begint, die exotherm is (warmte wordt geproduceerd tijdens de reactie). Vanaf dat moment verloopt de reactie snel.
Aluminium + fosfor → aluminiumfosfide
4 Al + P4 → 4 AlP
Toepassingen
Bij ongediertebestrijding (stopgezet gebruik)
Aluminiumfosfide werd in het verleden gebruikt als insecticide en als knaagdiermoordenaar. Hoewel het vanwege zijn giftigheid is verboden, wordt het in sommige delen van de wereld nog steeds gebruikt..
Het wordt gebruikt voor fumigatie in gesloten ruimtes waar verwerkte of onbewerkte landbouwvoedingsproducten (zoals granen), diervoeder en non-foodproducten aanwezig zijn..
Het doel is om insecten en knaagdieren te bestrijden die opgeslagen items, al dan niet eetbaar, aanvallen..
Het maakt het mogelijk om knaagdieren en insecten te bestrijden in niet-huishoudelijke, agrarische of niet-agrarische gebieden, buitenshuis of in hun holen en nesten te sproeien om te voorkomen dat ze bepaalde ziekten overdragen.


De vorm van gebruik bestaat erin AlP bloot te stellen aan lucht of vocht, aangezien fosfine of fosfaan PH vrijkomt.3 die veel organen van de te elimineren plaag beschadigt.

In andere toepassingen
Aluminiumfosfide AlP wordt gebruikt als een bron van fosfine of fosfaan PH3 en wordt gebruikt in halfgeleideronderzoek.
Theoretisch onderzoek van AlP-nanobuisjes
Er zijn theoretische studies uitgevoerd naar de vorming van aluminiumfosfide-AlP-nanobuisjes. Nanobuisjes zijn zeer kleine en zeer dunne cilinders die alleen zichtbaar zijn met een elektronenmicroscoop..
AlP-nanobuisjes met boor
Theoretische studies uitgevoerd door middel van computationele berekeningen tonen aan dat de onzuiverheden die aan de AlP-nanobuisjes kunnen worden toegevoegd, de theoretische eigenschappen van deze kunnen veranderen..
Er wordt bijvoorbeeld geschat dat het toevoegen van boor (B) -atomen aan AlP-nanobuisjes ze zou kunnen veranderen in halfgeleidertype-p. Een halfgeleider is een materiaal dat zich gedraagt als een geleider van elektriciteit of als een isolator, afhankelijk van het elektrische veld waaraan het wordt blootgesteld.
En een halfgeleidertype-p Dit is wanneer onzuiverheden aan het materiaal worden toegevoegd, in dit geval is AlP het uitgangsmateriaal en zouden de booratomen de onzuiverheden zijn. Halfgeleiders zijn handig voor elektronicatoepassingen.
AlP-nanobuisjes met gewijzigde structuur
Sommige wetenschappers hebben berekeningen uitgevoerd om het effect te bepalen van het veranderen van de kristalroosterstructuur van AlP-nanobuisjes van hexagonaal naar octaëdrisch..
Ze ontdekten dat manipulatie van de roosterstructuur kan worden gebruikt om de geleidbaarheid en reactiviteit van AlP-nanobuisjes te verfijnen en ze zo te ontwerpen dat ze bruikbaar zijn voor elektronica- en optische toepassingen..
Risico's
Contact met aluminiumfosfide kan de huid, ogen en slijmvliezen irriteren. Bij inslikken of inademen is het giftig. Kan door de huid worden opgenomen met toxische effecten.
Als AlP in contact komt met water, reageert het en vormt het fosfine of fosfaan PH3 die uiterst ontvlambaar is aangezien het in contact met lucht ontbrandt. Daarom kan het exploderen. Bovendien veroorzaakt fosfine de dood van mens en dier.
Aangezien aluminiumfosfide een goedkoop pesticide is, is het gebruik ervan een veelvoorkomende oorzaak van vergiftiging bij mensen en heeft het een hoog sterftecijfer..

Het reageert met de vochtigheid van de slijmvliezen en met het zoutzuur HCl in de maag en vormt het zeer giftige fosfaangas PH3. Daarom wordt door inademing en door inslikken fosfine in het lichaam gevormd, met fatale gevolgen..
De inname ervan veroorzaakt binnen enkele uren bloeding van het maagdarmkanaal, cardiovasculaire collaps, neuropsychiatrische stoornissen, ademhalings- en nierfalen..
AlP is zeer giftig voor alle land- en waterdieren.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Aluminiumfosfide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Sjögren, B. et al. (2007). Aluminium. Andere aluminiumverbindingen. In Handbook on the Toxicology of Metals (Third Edition). Opgehaald van sciencedirect.com.
- Gupta, R.C. en Crissman, J.W. (2013). Veiligheidsbeoordeling inclusief huidige en opkomende problemen in toxicologische pathologie. Risico voor de mens. In Haschek en Rousseaux's Handbook of Toxicology Pathology (derde editie). Opgehaald van sciencedirect.com.
- White, W.E. en Bushey, A.H. (1944). Aluminiumfosfide - Bereiding en samenstelling. Journal of The American Chemical Society 1944, 66, 10, 1666-1672. Opgehaald van pubs.acs.org.
- Mirzaei, Maryam en Mirzaei, Mahmoud. (2011). Een theoretische studie van met boor gedoteerde aluminiumfosfide-nanobuisjes. Computationele en theoretische chemie 963 (2011) 294-297. Opgehaald van sciencedirect.com.
- Takahashi, L. en Takahashi, K. (2018). Afstemming van de elektronische structuur van een aluminiumfosfide-nanobuis door middel van configuratie van de roostergeometrie. ACS Appl. Nano Mater. 2018, 1, 501-504. Opgehaald van pubs.acs.org.
- Gupta, P.K. (2016). Giftige effecten van pesticiden (landbouwchemicaliën). Aluminiumfosfide. In Fundamentals of Toxicology. Opgehaald van sciencedirect.com.



Niemand heeft nog op dit artikel gereageerd.