
Oppervlaktespanning oorzaken, voorbeelden, toepassingen en experimenten
De oppervlaktespanning Het is een fysieke eigenschap die alle vloeistoffen aanwezig zijn en wordt gekenmerkt door de weerstand die hun oppervlakken bieden tegen elke vergroting van hun oppervlakte. Dit is hetzelfde als zeggen dat het genoemde oppervlak het kleinst mogelijke gebied zal zoeken. Dit fenomeen verstrengelt verschillende chemische concepten, zoals cohesie, adhesie en intermoleculaire krachten..
Oppervlaktespanning is verantwoordelijk voor de vorming van oppervlaktekrommingen van vloeistoffen in buisvormige containers (maatcilinders, kolommen, reageerbuizen, enz.). Deze kunnen concaaf (gebogen in de vorm van een vallei) of convex (gebogen in een koepelvorm) zijn. Veel fysische verschijnselen kunnen worden verklaard door te kijken naar de veranderingen die de oppervlaktespanning van een vloeistof ondergaat..

Een van deze verschijnselen is de neiging van vloeibare moleculen om te agglomereren in de vorm van druppels, wanneer ze rusten op oppervlakken die ze afstoten. De waterdruppels die we op de bladeren zien, kunnen het bijvoorbeeld niet nat maken vanwege het wasachtige, hydrofobe oppervlak..
Er komt echter een tijd dat de zwaartekracht zijn rol speelt en de druppel als een waterkolom naar buiten stroomt. Een soortgelijk fenomeen doet zich voor in bolvormige kwikdruppels wanneer ze uit een thermometer worden gemorst.
Aan de andere kant is de oppervlaktespanning van water de belangrijkste van allemaal, omdat het bijdraagt aan en de toestand van microscopisch kleine lichamen in waterige media, zoals cellen en hun lipidenmembranen, organiseert. Bovendien is deze spanning verantwoordelijk voor het feit dat het water langzaam verdampt en dat sommige lichamen dichter op het oppervlak drijven dan het kan drijven..
Artikel index
- 1 Oorzaken van oppervlaktespanning
- 2 eenheden
- 3 Oppervlaktespanning van water
- 4 Andere voorbeelden
- 4.1 Gecondenseerde gassen
- 4.2 Niet-polaire vloeistoffen
- 4.3 Polaire vloeistoffen
- 5 Toepassingen
- 5.1 Wasmiddelen
- 5.2 Emulsies
- 6 eenvoudige experimenten
- 6.1 Clip-experiment
- 6.2 Papieren bootje
- 7 referenties
Oorzaken van oppervlaktespanning
De verklaring voor het fenomeen oppervlaktespanning ligt op moleculair niveau. De moleculen van een vloeistof interageren met elkaar, op zo'n manier dat ze samenhangend zijn in hun grillige bewegingen. Een molecuul heeft interactie met zijn buren ernaast en met die erboven of eronder.
Dit gebeurt echter niet hetzelfde met de moleculen op het oppervlak van de vloeistof, die in contact zijn met lucht (of een ander gas), of met een vaste stof. Moleculen op het oppervlak kunnen niet samenhangen met die van de externe omgeving.
Daardoor ervaren ze geen krachten die hen naar boven trekken; alleen naar beneden, van zijn buren in het vloeibare medium. Om deze onbalans tegen te gaan, 'knijpen' de oppervlaktemoleculen, omdat ze alleen op deze manier de kracht kunnen overwinnen die ze naar beneden duwt.
Er wordt dan een oppervlak gecreëerd waar de moleculen in een meer gespannen opstelling staan. Als een deeltje de vloeistof wil binnendringen, moet het eerst deze moleculaire barrière passeren evenredig met de oppervlaktespanning van die vloeistof. Hetzelfde geldt voor een deeltje dat vanuit de diepten van de vloeistof naar de externe omgeving wil ontsnappen..
Daarom gedraagt het oppervlak zich alsof het een elastische film is die bestand is tegen vervorming..
Eenheden
Oppervlaktespanning wordt meestal weergegeven door het symbool γ, en wordt uitgedrukt in eenheden N / m, kracht maal lengte. Meestal is de eenheid echter de dyn / cm. De ene kan in de andere worden omgezet door de volgende omrekeningsfactor:
1 dyn / cm = 0,001 N / m
Oppervlaktespanning van water
Water is de zeldzaamste en meest verbazingwekkende van alle vloeistoffen. De oppervlaktespanning en enkele van zijn eigenschappen zijn ongewoon hoog: 72 dyn / cm bij kamertemperatuur. Deze waarde kan oplopen tot 75,64 dyn / cm bij een temperatuur van 0 ºC; of afnemen tot 58,85 ºC, bij een temperatuur van 100 ºC.
Deze waarnemingen zijn logisch als je bedenkt dat de moleculaire barrière nog strakker wordt bij temperaturen rond het vriespunt, of dat hij wat losser wordt rond het kookpunt..
Water heeft een hoge oppervlaktespanning vanwege zijn waterstofbruggen. Als deze op zichzelf merkbaar zijn in de vloeistof, zijn ze nog meer aan de oppervlakte. Watermoleculen zijn sterk verstrengeld en vormen H-type dipool-dipool-interacties.tweeOH OH.

Hun interacties zijn zo efficiënt dat de waterige moleculaire barrière zelfs sommige lichamen kan ondersteunen voordat ze zinken. In de secties Toepassingen en Experimenten komt dit punt opnieuw aan de orde.
Andere voorbeelden
Alle vloeistoffen vertonen oppervlaktespanningen, hetzij in mindere of grotere mate dan water, hetzij zuivere stoffen of oplossingen. Hoe sterk en gespannen de moleculaire barrières van de oppervlakken zijn, hangt rechtstreeks af van hun intermoleculaire interacties, evenals van structurele en energetische factoren..
Gecondenseerde gassen
Bijvoorbeeld, moleculen van gassen in vloeibare toestand reageren alleen met elkaar via Londense dispersiekrachten. Dit komt overeen met het feit dat hun oppervlaktespanningen lage waarden hebben:
-Vloeibaar helium, 0,37 dyn / cm bij -273 ºC
-Vloeibare stikstof, 8,85 dyn / cm bij -196 ºC
-Vloeibare zuurstof, 13,2 dyn / cm bij -182 ºC
De oppervlaktespanning van vloeibare zuurstof is hoger dan die van helium omdat de moleculen een grotere massa hebben..
Apolaire vloeistoffen
Van apolaire en organische vloeistoffen wordt verwacht dat ze hogere oppervlaktespanningen hebben dan deze gecondenseerde gassen. Onder enkele daarvan hebben we de volgende:
-Diethylether, 17 dyn / cm bij 20 ° C
-n-Hexaan, 18,40 dyn / cm bij 20 ° C
-n-Octaan, 21,80 dyn / cm bij 20 ° C
-Tolueen, 27,73 dyn / cm bij 25 ºC
Een vergelijkbare trend wordt waargenomen voor deze vloeistoffen: de oppervlaktespanning neemt toe naarmate hun molecuulgewichten toenemen. Echter, de n-Octaan zou volgens dit de hoogste oppervlaktespanning moeten hebben en niet tolueen. Hier spelen moleculaire structuren en geometrieën een rol.
Tolueenmoleculen, plat en ringvormig, hebben effectievere interacties dan die van n-octaan. Daarom is het oppervlak van tolueen "strakker" dan het oppervlak van n-octaan-.
Polaire vloeistoffen
Omdat er sterkere dipool-dipool-interacties zijn tussen de moleculen van een polaire vloeistof, hebben ze de neiging om hogere oppervlaktespanningen te vertonen. Maar dit is niet altijd het geval. Enkele voorbeelden zijn:
-Azijnzuur, 27,60 dyn / cm bij 20 ° C
-Aceton, 23,70 dyn / cm bij 20 ° C
-Bloed, 55,89 dyn / cm bij 22 ° C
-Ethanol, 22,27 dyn / cm bij 20 ° C
-Glycerol, 63 dyn / cm bij 20 ° C
-Gesmolten natriumchloride, 163 dyn / cm bij 650 ° C
-6 M NaCl-oplossing, 82,55 dyn / cm bij 20 ° C
Gesmolten natriumchloride heeft naar verwachting een enorme oppervlaktespanning: het is een stroperige, ionische vloeistof..
Anderzijds is kwik een van de vloeistoffen met de hoogste oppervlaktespanning: 487 dyn / cm. Daarin bestaat het oppervlak uit sterk samenhangende kwikatomen, veel meer dan watermoleculen kunnen zijn..
Toepassingen

Oppervlaktespanning alleen heeft geen toepassingen. Dit betekent echter niet dat het niet betrokken is bij verschillende dagelijkse verschijnselen die, als ze niet zouden bestaan, niet zouden voorkomen..
Muggen en andere insecten kunnen bijvoorbeeld door water lopen. Dit komt omdat hun hydrofobe poten water afstoten, terwijl hun lage massa ervoor zorgt dat ze drijven op de moleculaire barrière zonder naar de bodem van de rivier, het meer, de vijver, enz. Te vallen..
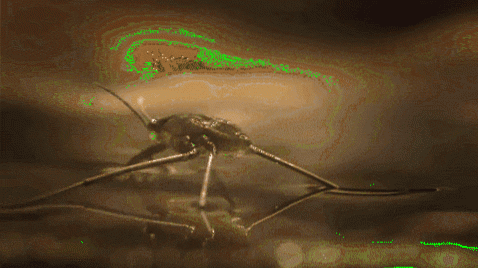
Oppervlaktespanning speelt ook een rol bij de bevochtigbaarheid van vloeistoffen. Hoe hoger de oppervlaktespanning, hoe minder de neiging om door poriën of scheuren in een materiaal te sijpelen. Bovendien zijn het niet erg bruikbare vloeistoffen om oppervlakken te reinigen.
Wasmiddelen
Het is hier waar reinigingsmiddelen werken, de oppervlaktespanning van het water verminderen en het helpen grotere oppervlakken te bedekken; terwijl het de ontvettende werking verbetert. Door zijn oppervlaktespanning te verlagen, maakt het ruimte voor luchtmoleculen, waarmee het bellen vormt..
Emulsies
Aan de andere kant zijn lage hogere spanningen gekoppeld aan de stabilisatie van de emulsies, die erg belangrijk zijn bij de formulering van een ander assortiment producten..
Simpele experimenten

Ten slotte worden enkele experimenten genoemd die in elke woonruimte kunnen worden uitgevoerd..
Clip experiment
Een metalen clip wordt op het oppervlak in een glas koud water geplaatst. Zoals te zien is in de afbeelding hierboven, blijft de clip drijven dankzij de oppervlaktespanning van het water. Maar als je een klein beetje lava van aardewerk aan het glas toevoegt, zal de oppervlaktespanning dramatisch dalen en zal de paperclip plotseling doorhangen..
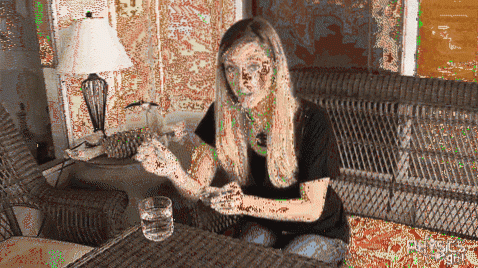
Papieren boot
Als we aan de oppervlakte een papieren bootje of een houten pallet hebben, en als de vaatwasser of het afwasmiddel aan de kop van een wattenstaafje wordt toegevoegd, dan doet zich een interessant fenomeen voor: er zal een afstoting zijn die ze naar de randen van de glas. De papieren boot en de houten pallet zullen wegschuiven van het met wasmiddel besmeurde wattenstaafje.

Een ander soortgelijk en meer grafisch experiment bestaat uit het herhalen van dezelfde operatie, maar dan in een emmer water besprenkeld met zwarte peper. De zwarte peperdeeltjes zullen wegdrijven en het oppervlak verandert van peper bedekt naar kristalhelder, met de peper aan de randen.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Wikipedia. (2020). Oppervlaktespanning. Hersteld van: en.wikipedia.org
- USGS. (s.f.). Oppervlaktespanning en water. Hersteld van: usgs.gov
- Jones, Andrew Zimmerman. (12 februari 2020). Oppervlaktespanning - definitie en experimenten. Hersteld van: thoughtco.com
- Susanna Laurén. (2017, 15 november). Waarom is oppervlaktespanning belangrijk? Biolin Scientific. Hersteld van: blog.biolinscientific.com
- Rookie Parenting Science. (07 november 2019). Wat is oppervlaktespanning | Cool wetenschappelijk experiment. Hersteld van: rookieparenting.com
- Jessica Munk. (2020). Oppervlaktespanningsexperimenten. Studie. Hersteld van: study.com
- De jongen zou dit moeten zien. (2020). Zeven experimenten met oppervlaktespanning - Physics Girl. Hersteld van: thekidshouldseethis.com


Niemand heeft nog op dit artikel gereageerd.