
Hemolysine-kenmerken, typen, werkingsmechanismen

De hemolysine Het is een klein eiwit dat poriën veroorzaakt in het celmembraan van erytrocyten en sommige andere cellen van het zoogdierbloed. Het wordt over het algemeen gesynthetiseerd en uitgescheiden door pathogene bacteriën.
Dit eiwit is een van de meest voorkomende microbiële toxines en is het best bestudeerd. Soms kan het hemolytische anemie veroorzaken, aangezien het aantal kanalen waardoor de cel binnenkomt zelfs cellysis kan veroorzaken.
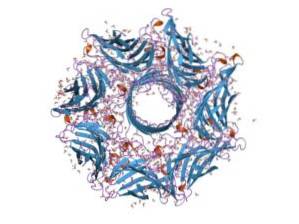
Over het algemeen is hemolysine een typisch toxine van de soort Streptococcus van het darmkanaal. Door zijn functie kunnen bacteriën de epitheliale barrière van het darmkanaal doorbreken en zo door de bloedbaan bewegen om andere weefsels te koloniseren..
De meest voorkomende vorm dat hemolysine in de natuur wordt aangetroffen, is in de α-hemolysinevorm. Dit eiwit is een van de belangrijkste virulentiefactoren van de meeste stammen van Escherichia coli en wat clostridia.
De meeste urineweginfecties worden veroorzaakt door stammen van Escherichia coli het produceren van a-hemolysine met hemolytische eigenschappen.
De productie van hemolysine en bacteriocine in bacteriestammen is in verband gebracht met een concurrentiemechanisme tegen de andere soorten en de productie van beide toxines lijkt af te hangen van dezelfde genetische determinanten in het genoom van de bacteriën..
Artikel index
- 1 Kenmerken
- 2 soorten
- 2.1 a-hemolysine
- 2.2 p-hemolysine
- 2.3 y-hemolysine
- 3 Werkingsmechanismen
- 3.1 Membraanbinding
- 3.2 Inbrengen van toxine in het membraan
- 3.3 oligomerisatie
- 4 referenties
Kenmerken
Hemolysine bestaat uit zeven subeenheden en het gen dat ervoor codeert, heeft zeven promotors. Deze zeven subeenheden worden ingebracht in het plasmamembraan van de doelwitcellen en vormen, wanneer ze samenkomen, een ionenkanaal waardoor metabolieten uit het binnenste van de cel ontsnappen..
Hemolysine is een extracellulair calcium (Ca + 2) -afhankelijk cytotoxine dat inwerkt op het plasmamembraan van bloedbaancellen. De poriën die het in het membraan creëert, zijn ook hydrofiel en zorgen ervoor dat water het celbinnenland binnendringt, wat kan leiden tot lysis..
Hemolysinen zijn typische eiwitproducten van gramnegatieve bacteriën en ze hebben allemaal twee kenmerken gemeen:
1- De aanwezigheid van een heel klein peptide (nonapeptide) dat bestaat uit herhalingen van de aminozuren glycine en asparaginezuur. De nonapeptiden van hemolysine bevinden zich nabij het C-terminale deel van de primaire structuur van het eiwit.
2- Alle hemolysines worden door de bacteriën uitgescheiden in de extracellulaire omgeving via een ABC-type transporter (ATP-Binding Cassette).
De productie van hemolysine wordt gewoonlijk gedetecteerd in bacteriestammen door groei op bloedagarmedium. In de test wordt een hemolytische halo waargenomen, een product van de afbraak van rode bloedcellen nabij de bacteriekolonies.
Types
Er zijn verschillende soorten hemolysinen, deze zijn geclassificeerd met een Griekse letter aan het begin van hun naam. De meest bestudeerde en meest voorkomende zijn α-, β- en γ-hemolysines, allemaal geproduceerd door de stam Staphylococcus aureus.
De soorten hemolysine worden geclassificeerd volgens het celbereik dat ze aanvallen en volgens hun primaire structuur van het eiwit..
a-hemolysine
Dit eiwit is typerend voor stammen van Staphylococcus aureus Y Escherichia colivalt neutrofielen, rode bloedcellen, lymfocyten, macrofagen, volwassen en embryonale fibroblasten aan. Werkt samen met de polaire koppen van de plasmamembraanlipiden van deze cellen om een hydrofobe staart van ongeveer 5 Ӑ in het membraan te internaliseren.
β-hemolysine
Gemaakt door Staphylococcus aureus In mindere mate dan α-hemolysine, valt β-hemolysine voornamelijk erytrocyten aan en komt het membraan uitsluitend binnen via de sfingomyeline-rijke domeinen van het celmembraan..
γ-hemolysine
Het is ook waargenomen in Staphylococcus aureus. Het is tegelijkertijd geclassificeerd als een hemolytisch eiwit en een leukotoxine, omdat het polymorfonucleaire cellen van mensen, monocyten, macrofagen en zelden zelfs rode bloedcellen aantast..
Dit type γ-hemolysine is een van de minst gekarakteriseerde, daarom is veel van zijn werkingsmechanisme onbekend en is het niet onderzocht in vivo.
Actiemechanismen
Het werkingsmechanisme dat relatief duidelijk is opgehelderd, is dat van α-hemolysine. Omdat het echter allemaal hemolytische eiwitten zijn, wordt aangenomen dat de meeste processen hetzelfde zijn voor alle hemolysinen..
Wetenschappers suggereren dat bacteriën om hemolysine in het milieu af te scheiden zich in een voedselarme micro-omgeving moeten bevinden, daarom zou dit een mechanisme zijn dat de cel ertoe aanzet om de doelwitcellen te vernietigen en hun voedingsstoffen te verkrijgen..
Het mechanisme is beschreven in drie stappen: celmembraanbinding, insertie en oligomerisatie..
Membraanbinding
Van hemolysinen is gevonden dat ze kunnen binden aan neutrofiele integrinen, en in erytrocyten is gevonden dat deze eiwitten binden aan geglycosyleerde componenten zoals glycoproteïnen, gangliosiden en celmembraan-glycoforinen..
Sommige auteurs suggereren dat de aanwezigheid van receptoren op het membraan niet essentieel is om hemolysinen te binden. In ieder geval is het mechanisme van cellulaire heropname van het eiwit nog niet precies bekend..
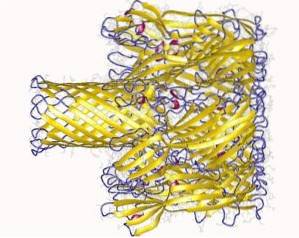
De interactie met het membraan verloopt in twee stappen:
- Initiële binding (reversibel): wanneer hemolysine zich bindt aan de calciumbindende domeinen van het membraan. Deze stap vindt plaats aan de oppervlakte en is zeer gevoelig voor elektrostatische ontlading..
- Onomkeerbare binding: verbindt de aminozuurdomeinen met de lipidecomponenten van de buitenste laag van het plasmamembraan van de doelcellen, om fysieke bindingen te vormen tussen de hydrofobe verbindingen van het membraan.
Inbrengen van toxine in het membraan
Α-hemolysine voegt residuen 177 en 411 in de eerste lipide-monolaag in. In de extracellulaire omgeving wordt hemolysine geassocieerd met calciumionen, die daarin een structurele rangschikking induceren en bijdragen aan de activering ervan..
Deze insertie consolideert de onomkeerbare hechting aan het celmembraan. Zodra de schikking heeft plaatsgevonden, wordt hemolysine een integraal eiwit, aangezien experimenteel is aangetoond dat de enige manier om het uit het membraan te extraheren is door het gebruik van detergenten zoals Triton X-100..
Oligomerisatie
Wanneer al het hemolysine in het plasmamembraan van de doelcellen is ingebracht, vindt de oligomerisatie van de 7 subeenheden waaruit het bestaat, plaats, wat eindigt in de vorming van een eiwitporie, zeer dynamisch maar afhankelijk van de lipidesamenstelling van het membraan ..
Er is waargenomen dat het oligomerisatieproces wordt bevorderd door de microdomeinen of lipidevlotten van het celmembraan. Deze regio's bevorderen de binding van het eiwit misschien niet, maar ze geven wel de voorkeur aan de oligomerisatie ervan zodra ze zijn ingebracht..
Hoe meer hemolysinen zich aan het membraan binden, hoe meer poriën er zullen worden gevormd. Bovendien kunnen hemolysinen elkaar oligomeriseren (aangrenzende) en veel grotere kanalen vormen..
Referenties
- Bakás, L., Ostolaza, H., Vaz, W. L., & Goñi, F. M. (1996). Omkeerbare adsorptie en onomkeerbare insertie van Escherichia coli alfa-hemolysine in lipidedubbellagen. Biophysical journal, 71 (4), 1869-1876.
- Dalla Serra, M., Coraiola, M., Viero, G., Comai, M., Potrich, C., Ferreras, M.,… & Prévost, G. (2005). Staphylococcus aureus bicomponent γ-hemolysines, HlgA, HlgB en HlgC, kunnen gemengde poriën vormen die alle componenten bevatten. Journal of chemische informatie en modellering, 45 (6), 1539-1545.
- Gow, J. A., en Robinson, J. (1969). Eigenschappen van gezuiverd stafylokokken β-hemolysine. Journal of bacteriology, 97 (3), 1026-1032.
- Ike, Y., Hashimoto, H., & Clewell, D. B. (1984). Hemolysine van Streptococcus faecalis ondersoort zymogenes draagt bij aan virulentie bij muizen. Infectie en immuniteit, 45 (2), 528-530.
- Remington, J. S., Klein, J. O., Wilson, C. B., Nizet, V., & Maldonado, Y. A. (Eds.). (1976). Infectieziekten van de foetus en pasgeboren baby (Vol. 4). Philadelphia: Saunders.
- Todd, E. W. (1932). Antigeen streptokokken hemolysine. Journal of experimentele geneeskunde, 55 (2), 267-280.



Niemand heeft nog op dit artikel gereageerd.