
Cyclische koolwaterstoffen structuur, eigenschappen, voorbeelden

De cyclische koolwaterstoffen Het zijn organische verbindingen die bestaan uit koolstof- en waterstofatomen die zich verbinden om ringen of cyclische structuren te vormen. Er zijn hoofdzakelijk drie soorten: alicyclisch, aromatisch en polycyclisch.
Deze soorten koolwaterstoffen kunnen dan bestaan uit de gesloten versies van de alkanen, alkenen en alkynen; ringen hebben met aromatische systemen, zoals benzeen en zijn derivaten; of complexe en fascinerende structuren presenteren. Van alle zijn alicyclische tekens de eenvoudigste en worden ze meestal weergegeven door polygonen te gebruiken.
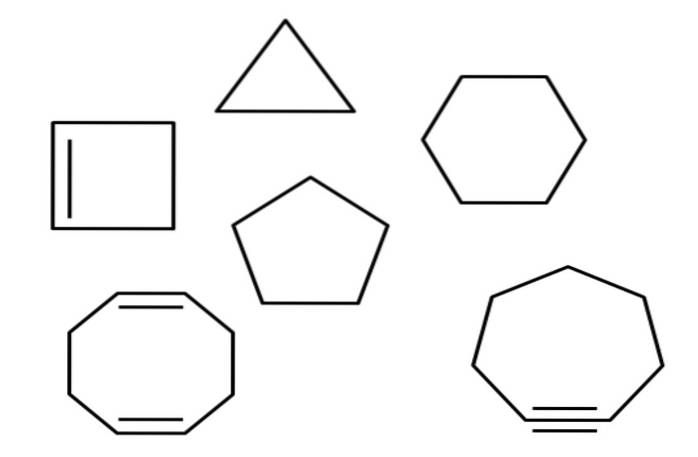
Hierboven heb je bijvoorbeeld meerdere alicyclische koolwaterstoffen. Ze zien eruit als eenvoudige polygonen: een vierkant, driehoek, vijfhoek, zeshoek, enz. Als een van zijn CC-bindingen met een schaar zou kunnen worden doorgeknipt, zou het resultaat een alkaan, alkeen (als het dubbele bindingen heeft) of alkyn (als het drievoudige bindingen heeft) zijn..
Hun eigenschappen verschillen niet veel van de koolwaterstoffen met open keten waaruit ze afkomstig zijn; hoewel, chemisch gezien, hoe groter ze zijn, hoe stabieler ze zullen zijn, en hun interactie met een moleculair medium meer uitgesproken wordt (vanwege hun grotere contactoppervlak).
Artikel index
- 1 Structuur
- 1.1 Conformaties
- 2 Eigenschappen
- 2.1 Intermoleculaire krachten
- 3 Nomenclatuur
- 4 voorbeelden
- 5 referenties
Structuur
Als we direct naar de kwestie gaan die betrekking heeft op hun structuren, moet worden verduidelijkt dat ze niet plat zijn, ook al lijken ze dat in hun weergave van veelhoeken. De enige uitzondering op deze bewering wordt gevonden in cyclopropaan (de driehoek), aangezien de drie punten noodzakelijkerwijs op hetzelfde vlak moeten rusten..
Ook moet worden verduidelijkt dat de termen 'cycli' en 'ringen' vaak onderling uitwisselbaar zijn; een ring hoeft niet cirkelvormig te zijn en kan daarom eindeloze geometrieën krijgen zolang het een gesloten structuur is. Cyclopropaan zou dan een driehoekige ring of cyclus hebben.
Alle koolstofatomen hebben sp-hybridisaties3, dus hun geometrieën zijn tetraëdrisch en hun bindingen zouden idealiter gescheiden moeten zijn door een hoek van 109,5 °; dit is echter niet mogelijk voor structuren zo gesloten als cyclopropaan, cyclobutaan (vierkant) of cyclopentaan (vijfhoek).
We spreken dan van een spanning die het molecuul destabiliseert, en wordt experimenteel bepaald door de gemiddelde verbrandingswarmte van elke CH-groep te meten.twee.
Conformaties
En wat gebeurt er als er dubbele of driedubbele bindingen zijn? De spanning neemt toe, want waar er een is, zal de constructie gedwongen worden te "krimpen" en vlak te blijven; die achtereenvolgens de ene conformatie boven de andere zou dwingen, waarschijnlijk in de buurt van aangrenzende waterstofatomen.

In de bovenstaande afbeelding worden twee conformeren voor cyclohexaan getoond om het bovenstaande te verklaren. De atomen die zich op de posities bevinden naar of en ze zouden respectievelijk axiaal of equatoriaal zijn. Merk op dat je in plaats van een platte zeshoek een stoel (links) en een boot (rechts) hebt.
Deze structuren zijn dynamisch en brengen een evenwicht tussen hen tot stand. Als de atomen in naar ze zijn erg volumineus, de ring zal "geschikt" zijn om ze in de equatoriale posities te positioneren; omdat ze daar naar de zijkanten van de ring zijn gericht (wat de intermoleculaire interacties zou versterken of verzwakken).
Als we elke koolstof afzonderlijk bekijken, zullen we zien dat ze tetraëdrisch zijn. Dit zou niet het geval zijn als er een dubbele binding was: hun sp-hybridisatiestwee ze zouden de structuur dwingen af te vlakken; en als er een drievoudige binding is, uitlijnen. De vlakke structuur van benzeen is hiervan de maximale weergave.
Eigendommen
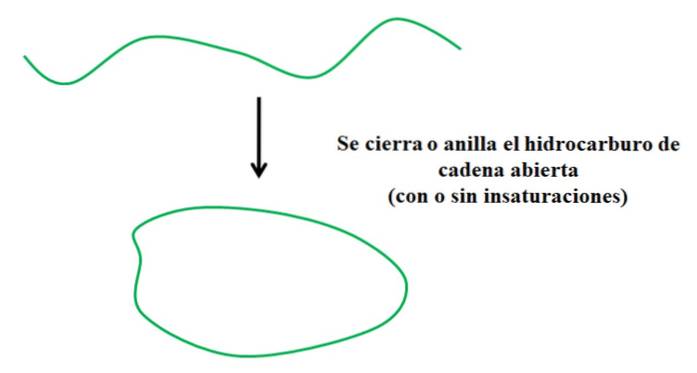
Stel dat u een koolwaterstof met een open keten heeft (met of zonder onverzadigingen of vertakkingen). Als we de uiteinden zouden kunnen verbinden, zou het een ring of cyclus creëren (zoals in de afbeelding hierboven).
Vanuit het oogpunt van organische synthese gebeurt dit niet zomaar; er moeten goede vertrekkende groepen zijn verbonden aan de uiteinden van de ketting, die bij het weggaan het sluiten van de ketting bevorderen (als de oplossing erg verdund is).
Met dit in gedachten kan worden gezien dat de groene sporenkoolwaterstof alleen een transformatie ondergaat met betrekking tot zijn structuur; zonder te breken of nieuwe bindingen met andere atomen toe te voegen. Het betekent dat het chemisch hetzelfde blijft voor en na het sluiten of omgorden..
Daarom verschillen de chemische of fysische eigenschappen van deze alicyclische koolwaterstoffen niet te veel van hun tegenhangers met een open keten. Beide zijn reactief tegen dezelfde soort (d.w.z. halogenen onder ultraviolet licht) en kunnen sterke oxidatie ondergaan of verbranden door warmte vrij te geven..
Intermoleculaire krachten
Er is een onmiskenbaar feit: de ring heeft een groter contactoppervlak dan de open ketting en daarom zijn de intermoleculaire interacties sterker.
Het resultaat is dat hun kook- en smeltpunt meestal hoger zijn, evenals hun dichtheden. Er kunnen zoveel verschillen worden opgemerkt in hun brekingsindexen of dampdrukken.
Nomenclatuur
Terugkerend naar het voorbeeld van de koolwaterstof met een groene streep, blijft de nomenclatuur ongewijzigd zodra deze zich in zichzelf heeft gesloten (zoals een slang die in zijn eigen staart bijt). Daarom blijven de naamgevingsregels hetzelfde; tenzij polycyclische of aromatische koolwaterstoffen worden behandeld.
Hieronder worden drie verbindingen weergegeven, die hun eigennamen zullen krijgen:
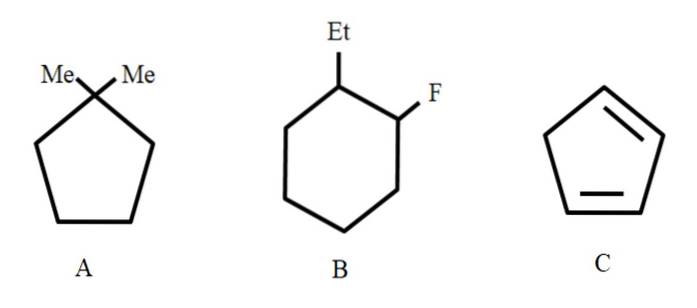
Om te beginnen, omdat het gesloten structuren zijn, wordt de voorvoegselcyclus gebruikt om ernaar te verwijzen (hier is de woordring gedegradeerd).
Van links naar rechts hebben we: een cyclopentaan, een cyclohexaan en nog een cyclopentaan. De koolstofatomen zijn zo gerangschikt dat de substituenten de kleinste cijfers krijgen, en ze worden ook in alfabetische volgorde vermeld..
A is dus: 1,1-dimethylcyclopentaan. In B beginnen we met de ethylsubstituent vóór fluor te noemen, dus de naam is: 1-ethyl-2-fluorocyclohexaan. En dan voor C worden de dubbele bindingen als substituenten genomen, het aantal koolstofatomen dat het vormt moet worden aangegeven: 1,3-cyclopentadieen.
Voorbeelden
In het artikel wordt melding gemaakt van verschillende cyclische koolwaterstoffen. In de eerste afbeelding is te vinden: cyclopropaan, cyclobutaan, cyclopentaan, cyclohexaan, cycloheptaan en cyclooctaan.
Er kan een breed scala aan derivaten van worden verkregen, en het is voldoende om er dubbele of drievoudige bindingen op te plaatsen om respectievelijk cycloalkenen of cycloalkinen te hebben. En met betrekking tot aromatische koolwaterstoffen is het voldoende om de benzeenring in gedachten te houden en deze in twee dimensies te vervangen of te reproduceren..
De meest buitengewone (en problematische als het gaat om het begrijpen van hun nomenclatuur) zijn echter polycyclische koolwaterstoffen; dat wil zeggen, eenvoudige polygonen zijn zelfs niet genoeg om ze op een eenvoudige manier weer te geven. Drie daarvan zijn het vermelden waard: Cuban, Canastano en Pagoda (afbeeldingen hieronder).
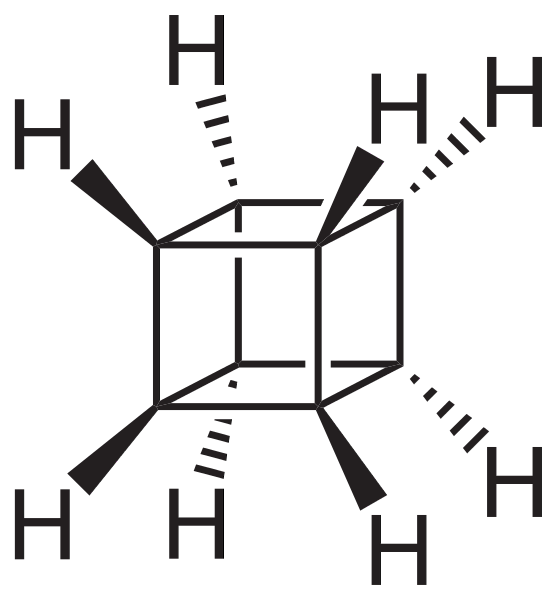
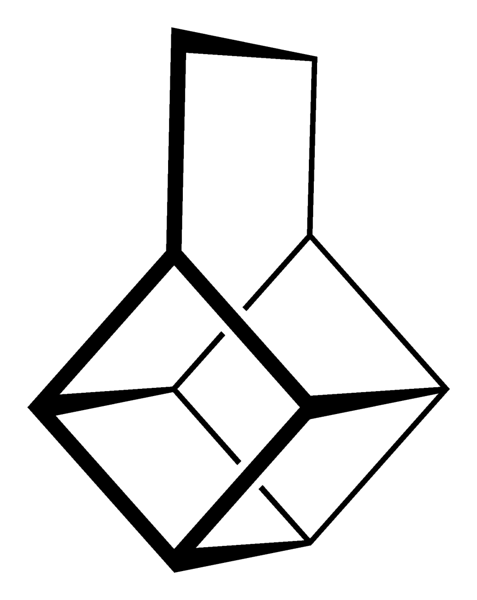

Elk van hen heeft zijn complexe synthesemethodologie, zijn geschiedenis, kunst en een latente fascinatie voor de oneindige structurele mogelijkheden die eenvoudige koolwaterstoffen kunnen bereiken..
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Reid Danielle. (2019). Cyclische koolwaterstoffen: definitie en voorbeeld. Studie. Hersteld van: study.com
- Stichting CK-12. (05 juni 2019). Cyclische koolwaterstoffen. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- Wikipedia. (2019). Cyclische verbinding. Hersteld van: en.wikipedia.org
- Cowboy Miguel. (2019). Cyclische koolwaterstoffen. Hersteld van: deciencias.net



Niemand heeft nog op dit artikel gereageerd.