
Eigenschappen, reactiviteit en toepassingen van calciumhydride (CaH2)

De calciumhydride Het is een chemische verbinding met de formule CaH2, waardoor het een aardalkalimetaalhydride is. Deze chemische verbinding heeft twee ionische bindingen tussen calcium en de twee hydride-ionen, zoals weergegeven in figuur 1.
Het is een zout hydride, wat betekent dat de structuur vergelijkbaar is met zout. De kristallijne structuur is dezelfde als die van loodchloride (cotunniet-mineraal), zoals weergegeven in figuur 2.
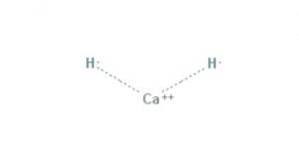
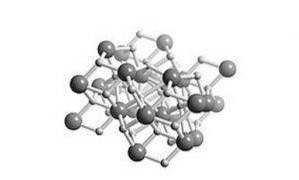
Alle alkali- en aardalkalimetalen vormen hydridezouten. In de chemie is een hydride het anion van waterstof, H- of, vaker, is het een verbinding waarin een of meer waterstofcentra nucleofiele, reducerende of basische eigenschappen hebben..
In verbindingen die als hydriden worden beschouwd, is het waterstofatoom gehecht aan een meer elektropositief element of groep.
Het kan worden geproduceerd door calcium en waterstof te laten reageren bij een temperatuur tussen 300 en 400 graden Celsius. Een andere manier om calciumhydride te bereiden, is door calciumchloride samen met waterstof en metallisch natrium te verwarmen. De reactie verloopt als volgt:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
In deze reactie creëren calcium (Ca) en waterstof (H) een molecuul calciumhydride, terwijl natriumatomen samen met chloor moleculen natriumchloride (NaCl) creëren..
Calciumhydride kan ook worden geproduceerd door calciumoxide (CaO) te verminderen met magnesium (Mg). De reactie wordt uitgevoerd in aanwezigheid van waterstof. Deze reactie produceert ook magnesiumoxide (MgO). Hieronder staat de formule voor deze chemische reactie:
CaO + Mg + H2 → CaH2 + MgO
Artikel index
- 1 Fysische en chemische eigenschappen van calciumhydride
- 2 Reactiviteit en gevaren
- 3 Behandeling en opslag
- 4 Gebruik en toepassingen
- 4.1 Droogmiddel
- 4.2 Waterstofproductie
- 4.3 Reductiemiddel
- 5 Nadeel bij het gebruik van calciumhydride
- 6 referenties
Fysische en chemische eigenschappen van calciumhydride
Calciumhydride is een set kristallen met een orthorhombische structuur van witte kleur als ze puur zijn. Over het algemeen is het zeldzaam om het in deze vorm te vinden, dus het heeft meestal een grijsachtige tint. Het mist een karakteristieke geur. Het uiterlijk is weergegeven in figuur 3 (Royal Society of Chemistry, 2015).

Het heeft een molecuulgewicht van 42,094 g / mol, een smeltpunt van 816 graden Celsius en een dichtheid van 1,70 g / ml. Als het in water oplost, reageert het heftig en produceert het waterstof. Reageert ook met alcohol (National Center for Biotechnology Information., S.F.).
Reactiviteit en gevaren
Calciumhydride is een stabiele chemische stof, hoewel het zeer reactief is met water of vocht. In contact met water komen ontvlambare waterstofgassen vrij die spontaan kunnen ontbranden.
Het wordt als een explosieve verbinding beschouwd. Bij verhitting in een reactie met tetrahydrofuraan kan het een explosie veroorzaken. Wanneer het wordt gemengd met chloraat, hypochloriet, bromaat, kaliumperchloraat, wordt het gevoelig voor hitte, wrijving en wordt het explosief (Calcium Hydride 7789-78-8, 2016).
Wanneer zilverfluoride wordt vermalen met calciumhydride, wordt de massa gloeiend. Sterke verhitting van het hydride met chloor, broom of jodium leidt tot gloeien.
Mengsels van het hydride met verschillende bromaten, bijvoorbeeld bariumbromaat of chloraten, bijvoorbeeld bariumchloraat en perchloraten zoals kaliumperchloraat, exploderen bij het malen. CaH2 reageert gloeiend met zilverfluoride als het onderhevig is aan wrijving.
Deze verbinding moet worden gehanteerd onder een inerte atmosfeer. Als het niet op de juiste manier wordt behandeld, kan het een ernstige bedreiging vormen voor de gezondheid en veiligheid van laboratoriumpersoneel, eerstehulpverleners en verwerkers van chemisch afval (UC-centrum voor laboratoriumveiligheid, 2013).
Uiterst gevaarlijk in geval van contact met de huid of ogen, aangezien het irriterend is. Zeer gevaarlijk in geval van contact met de huid, aangezien het bijtend kan zijn.
Het is ook gevaarlijk bij inslikken en inademen. De hoeveelheid weefselschade hangt af van de lengte van het contact. Contact met de ogen kan leiden tot beschadiging van het hoornvlies of blindheid..
Contact met de huid kan ontstekingen en blaren veroorzaken. Het inademen van stof veroorzaakt irritatie van het maagdarmkanaal of de luchtwegen, gekenmerkt door verbranding, niezen en hoesten..
Ernstige overmatige blootstelling kan leiden tot longschade, verstikking, bewusteloosheid en zelfs de dood. Ontsteking van het oog wordt gekenmerkt door roodheid, tranen en jeuk. Ontsteking van de huid wordt gekenmerkt door jeuk, schilfering, roodheid of soms blaarvorming.
Herhaalde blootstelling aan een laag niveau kan oogirritatie veroorzaken. Herhaalde blootstelling van de huid kan plaatselijke vernietiging van de huid of dermatitis veroorzaken..
Herhaaldelijk inademen van stof kan in verschillende mate irritatie van de luchtwegen of longschade veroorzaken. Herhaaldelijk of langdurig inademen van stof kan chronische irritatie van de luchtwegen veroorzaken (Material Safety Data Sheet Calcium hydride MSDS, 2005).
In geval van contact met de ogen, moeten ze onmiddellijk worden gespoeld met veel water gedurende tenminste 15 minuten, waarbij de boven- en onderoogleden af en toe worden opgetild..
In geval van contact met de huid, onmiddellijk spoelen met veel water gedurende tenminste 15 minuten en daarbij verontreinigde kleding en schoenen uittrekken..
Bij inslikken mag braken niet worden opgewekt. Er moet een antigifcentrum worden gebeld. Het is raadzaam om de plaats van blootstelling te verlaten en onmiddellijk naar de buitenlucht te gaan.
Bij inademing en bij ademhalingsmoeilijkheden is het noodzakelijk om zuurstof toe te voeren. Mond-op-mondbeademing mag niet worden gegeven als het slachtoffer de stof heeft ingeslikt of ingeademd..
Kunstmatige beademing moet worden opgewekt met behulp van een zakmasker met een eenrichtingsklep of een ander geschikt medisch beademingsapparaat. In alle gevallen moet onmiddellijk medische hulp worden ingeroepen..
Behandeling en opslag
De verbinding moet in een droge container worden bewaard, uit de buurt van hitte. Het moet uit de buurt van ontstekingsbronnen worden gehouden. Stof mag niet worden ingeademd. Er mag geen water aan dit product worden toegevoegd
Draag bij onvoldoende ventilatie een geschikt ademhalingsapparaat, zoals een filtermasker. In geval van blootstelling medische hulp inroepen en indien mogelijk het etiket tonen. Aanraking met huid en ogen vermijden.
Brandbare materialen dienen in het algemeen in een aparte veiligheidskast of opslagruimte te worden bewaard. Houd de container goed gesloten.
Op een koele en goed geventileerde plaats bewaren. Alle apparatuur die materiaal bevat, moet worden geaard om elektrische vonken te voorkomen. De container moet droog en op een koele plaats worden bewaard.
Het is een onbrandbaar materiaal. Brandweerlieden moeten echter geschikte uitrusting dragen tijdens het bestrijden van een brand rond deze chemische verbinding..
Het is nooit aan te raden om water te gebruiken om een brand rond calciumhydride te blussen. Hiervoor kunnen zowel droog zand als verbindingen als natriumchloride en natriumcarbonaat worden gebruikt..
Om afvalcalciumhydride te verwijderen, moet het worden afgebroken door 25 ml methanol voor elke gram hydride onder een stikstofatmosfeer onder roeren toe te voegen..
Zodra de reactie is voltooid, wordt hetzelfde volume water toegevoegd aan de waterige verbinding van calciummethoxide en wordt het met veel water in de afvoer afgevoerd (nationale onderzoeksraad, 1995).
Toepassingen en toepassingen
Droogmiddel
Kaliumhydride is een relatief mild droogmiddel. Om deze reden is het gebruik van deze verbinding als droogmiddel veiliger in vergelijking met meer reactieve middelen, zoals natrium-kalium en natriummetaallegeringen. Reageert als volgt met water:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
De hydrolyseproducten van deze reactie, waterstof (gas) en Ca (OH) 2 (een waterig mengsel), kunnen worden gescheiden van het chemische oplosmiddel na een proces van filtratie, destillatie of decantatie..
Deze chemische verbinding is een effectief droogmiddel voor veel basische oplosmiddelen zoals aminen en pyridine. Soms gebruikt om oplosmiddelen voor te drogen voordat reactievere droogmiddelen worden gebruikt.
Waterstofproductie
In de jaren veertig was deze verbinding verkrijgbaar als waterstofbron onder de handelsnaam "Hydrolith"..
Het wordt al heel lang als waterstofbron gebruikt. Het wordt nog steeds gebruikt om zuivere waterstof te produceren in laboratoria voor verschillende experimenten, geavanceerde brandstofcellen en batterijtoepassingen (American Elements, S.F.).
De compound wordt al decennia lang veel gebruikt als een veilig en gemakkelijk middel om weerballonnen op te blazen..
Het wordt ook regelmatig gebruikt in laboratoria om kleine hoeveelheden zeer zuivere waterstof te produceren voor experimenten. Het vochtgehalte van dieselbrandstof wordt berekend uit de waterstof ontwikkeld na behandeling met CaH2.
Reductiemiddel
Bij verhitting tussen 600 en 1000 graden Celsius kunnen zirkoniumoxide, niobium, uranium, chroom, titanium, vanadium en tantaal worden gereduceerd om het poeder van deze metalen te bereiden, zodat calciumhydride kan worden gebruikt in de metallurgie van stof.
De volgende reactie illustreert hoe calciumhydride werkt als een reductiemiddel:
TiO + 2CaH2 → CaO + H2 + Ti
Nadeel bij het gebruik van calciumhydride
Deze chemische verbinding heeft vaak de voorkeur als droogmiddel; Het heeft echter ook enkele nadelen:
-De drogende werking van deze verbinding is traag, aangezien het niet oplosbaar is in enig oplosmiddel waarmee het niet heftig reageert..
-Deze poedervormige verbinding is incompatibel met veel oplosmiddelen. Zijn reactie met chloorkoolwaterstoffen kan zelfs explosies veroorzaken.
-Het kan niet worden gebruikt voor het deoxygeneren van oplosmiddelen omdat het geen opgeloste zuurstof kan verwijderen.
-Onderscheid maken tussen calciumhydride en calciumhydroxide is vrij moeilijk vanwege hun vergelijkbare uiterlijk.
Referenties
- Amerikaanse elementen. (S.F.). calciumhydride. Opgehaald van americanelements.com: americanelements.com.
- Calciumhydride 7789-78-8. (2016). Opgehaald van chemicalbook.com: chemicalbook.com.
- calciumhydride. (s.f.). Opgehaald van scheikundeleerling: chemistrylearner.com.
- Veiligheidsinformatieblad Calciumhydride MSDS. (2005, 10 oktober). Opgehaald van sciencelab.com: sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie. (S.F.). PubChem samengestelde database; CID = 105052. Opgehaald van pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- nationale onderzoeksraad. (negentienvijfennegentig). Voorzichtige praktijken in het laboratorium: behandeling en verwijdering van chemicaliën. Washinton: NationalAacademy Press.
- Royal Society of Chemistry. (2015). calciumhydride-ID 94784. Opgehaald van chemspider.com: chemspider.com.
- UC-centrum voor laboratoriumveiligheid. (2013, 18 januari). standaard werkwijze calciumhydride. Opgehaald van chemengr.ucsb.edu: chemengr.ucsb.edu.


Niemand heeft nog op dit artikel gereageerd.