
Eigenschappen, risico's en toepassingen van bariumhydroxide (Ba (OH) 2)
De bariumhydroxide is een chemische verbinding met de formule Ba (OH)twee(H.tweeOF)X. Het is een sterke basis en kan in watervrije, monohydraat- of octohydraatvorm zijn. De monohydraatvorm, ook wel barietwater genoemd, is de meest voorkomende en commercieel gebruikte vorm. De structuur van de watervrije en monohydraatverbindingen wordt weergegeven in Figuur 1.
Bariumhydroxide kan worden bereid door bariumoxide (BaO) op te lossen in water: BaO + 9HtweeO → Ba (OH)twee8HtweeO. Het kristalliseert als het octahydraat, dat het monohydraat wordt bij verhitting in lucht. Bij 100 ° C onder vacuüm zal het monohydraat BaO en water produceren.
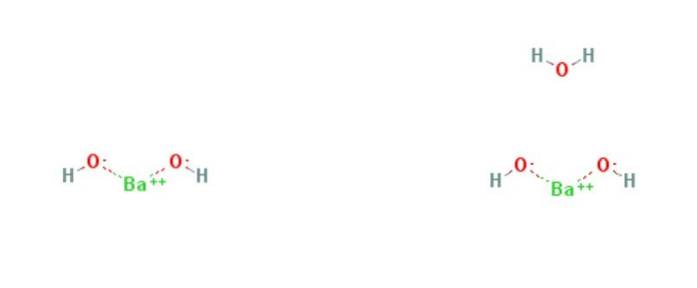
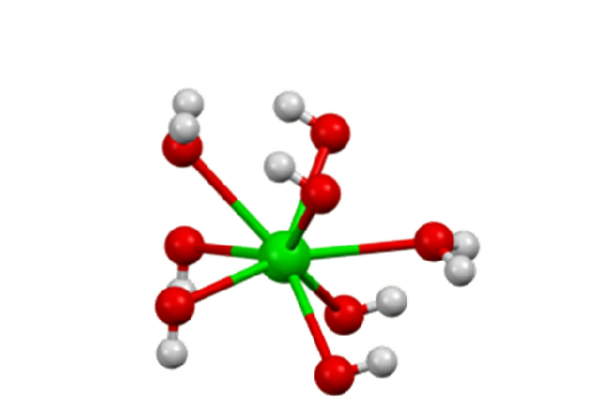
Het monohydraat neemt een gelaagde structuur aan (figuur 2). The Ba geeft voortwee+ ze nemen een octaëdrische geometrie aan. Elk centrum Batwee+ is gebonden door twee waterliganden en zes hydroxideliganden, die respectievelijk dubbel en driedubbel overbrugd zijn naar de Ba-centratwee+ buren.
In het octahydraat centreert de Batwee+ Individuen hebben weer acht coördinaten maar delen geen liganden (Barium Hydroxide, S.F.).
Artikel index
- 1 Eigenschappen van bariumhydroxide
- 2 Reactiviteit en gevaren
- 2.1 Oogcontact
- 2.2 Huidcontact
- 2.3 Inademing
- 2.4 Inslikken
- 3 toepassingen
- 3.1 1- Industrie
- 3.2 2- Laboratorium
- 3.3 3- Katalysator in de Wittig-Horner-reactie
- 3.4 4- Andere toepassingen
- 4 referenties
Bariumhydroxide-eigenschappen
Bariumhydroxide is witte of transparante octaëdrische kristallen. Geurloos en met een bijtende smaak (National Center for Biotechnology Information., 2017). Het uiterlijk wordt getoond in figuur 3 (IndiaMART InterMESH Ltd., S.F.).

De watervrije vorm heeft een molecuulgewicht van 171,34 g / mol, een dichtheid van 2,18 g / ml, een smeltpunt van 407 ° C en een kookpunt van 780 ° C (Royal Society of Chemistry, 2015).
De monohydraatvorm heeft een molecuulgewicht van 189,355 g / mol, een dichtheid van 3,743 g / ml en een smeltpunt van 300 ° C (Royal Society of Chemistry, 2015).
De octohydraatvorm heeft een molecuulgewicht van 315,46 g / mol, een dichtheid van 2,18 g / ml en een smeltpunt van 78 ° C (Royal Society of Chemistry, 2015).
De verbinding is slecht oplosbaar in water en onoplosbaar in aceton. Het is een sterke basis met een pKa van 0,15 en 0,64 voor de eerste en tweede OH- respectievelijk.
Bariumhydroxide reageert op dezelfde manier als natriumhydroxide (NaOH), maar is minder oplosbaar in water. Neutraliseert zuren exotherm om zouten plus water te vormen. Kan reageren met aluminium en zink om metaaloxiden of hydroxiden te vormen en waterstofgas te genereren.
Kan polymerisatiereacties initiëren in polymeriseerbare organische verbindingen, vooral epoxiden.
Het kan ontvlambare en / of giftige gassen genereren met ammoniumzouten, nitriden, gehalogeneerde organische verbindingen, verschillende metalen, peroxiden en hydroperoxiden. Mengsels met gechloreerde gommen exploderen wanneer ze worden verwarmd of geplet (BARIUM HYDROXIDE MONOHYDRATE, 2016).
Bariumhydroxide ontleedt tot bariumoxide bij verhitting tot 800 ° C. Reactie met kooldioxide produceert bariumcarbonaat. De sterk alkalische waterige oplossing ondergaat neutralisatiereacties met zuren. Het vormt dus bariumsulfaat en bariumfosfaat met respectievelijk zwavelzuur en fosforzuur..
H.tweeSW4 + Ba (OH)twee Baso4 + 2HtweeOF
Reactie met waterstofsulfide produceert bariumsulfide. Neerslag van veel onoplosbare of minder oplosbare bariumzouten kan het gevolg zijn van een dubbele vervangingsreactie wanneer een waterige oplossing van bariumhydroxide wordt gemengd met veel oplossingen van andere metaalzouten..
Het mengen van het vaste gehydrateerde bariumhydroxide met vast ammoniumchloride in een bekerglas produceert een endotherme reactie om een vloeistof te produceren, waarbij ammoniak vrijkomt. De temperatuur daalt drastisch tot ongeveer -20ºC (Royal Society of Chemistry, 2017).
Ba (OH)twee (s) + 2NH4Cl (s) → BaCltwee (aq) + 2NH3 (g) + HtweeOF

Ba (OH) 2 reageert met kooldioxide om bariumcarbonaat te produceren. Dit komt tot uiting door de volgende chemische reactie:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Reactiviteit en gevaren
Bariumhydroxide wordt geclassificeerd als een stabiele, niet-brandbare verbinding die snel en exotherm reageert met zuren en onverenigbaar is met kooldioxide en vocht. De verbinding is giftig en, als sterke basis, bijtend.
Inademing, inslikken of huidcontact met materiaal kan ernstig letsel of de dood tot gevolg hebben. Contact met de gesmolten stof kan ernstige brandwonden aan huid en ogen veroorzaken..
Contact met de huid moet worden vermeden. De effecten van contact of inademing kunnen vertraagd zijn. Bij brand kunnen irriterende, bijtende en / of giftige gassen vrijkomen. Afvalwater van brandbestrijding kan bijtend en / of giftig zijn en verontreiniging veroorzaken.
Oogcontact
Als de verbinding in contact komt met de ogen, moeten de contactlenzen worden gecontroleerd en verwijderd. Ogen moeten onmiddellijk worden gespoeld met veel water gedurende tenminste 15 minuten, met koud water.
Huidcontact
In geval van contact met de huid, moet het getroffen gebied onmiddellijk gedurende minstens 15 minuten worden afgespoeld met veel water of een zwak zuur, bijvoorbeeld azijn, terwijl verontreinigde kleding en schoenen worden verwijderd. Bedek geïrriteerde huid met een verzachtend middel.
Was kleding en schoenen voordat u ze opnieuw gebruikt. Als het contact ernstig is, was dan met een desinfecterende zeep en bedek de besmette huid met een antibacteriële crème..
Inademing
Bij inademing moet het slachtoffer naar een koele plaats worden verplaatst. Als de patiënt niet ademt, wordt kunstmatige beademing gegeven. Bij ademhalingsmoeilijkheden zuurstof toedienen.
Inslikken
Als de verbinding wordt ingeslikt, mag braken niet worden opgewekt. Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas.
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen (veiligheidsinformatieblad bariumhydroxide monohydraat, 2013).
Toepassingen
1- Industrie
Industrieel wordt bariumhydroxide gebruikt als voorloper van andere bariumverbindingen. Monohydraat wordt gebruikt om sulfaat uit verschillende producten te dehydrateren en te verwijderen. Deze toepassing maakt gebruik van de zeer lage oplosbaarheid van bariumsulfaat. Deze industriële toepassing is ook van toepassing op laboratoriumtoepassingen.
Bariumhydroxide wordt gebruikt als additief in thermoplasten (zoals fenolharsen), krassen en PVC-stabilisatoren om de plastische eigenschappen te verbeteren. Dit materiaal wordt gebruikt als een algemeen additief voor smeermiddelen en vetten..
Andere industriële toepassingen van bariumhydroxide zijn onder meer suikerproductie, productie van zeep, verzeping van vet, het smelten van silicaat en chemische synthese van andere bariumverbindingen en organische verbindingen (BARIUM HYDROXIDE, S.F.).
2- Laboratorium
Bariumhydroxide wordt in de analytische chemie gebruikt voor de titratie van zwakke zuren, in het bijzonder organische zuren. De heldere waterige oplossing is gegarandeerd carbonaatvrij, in tegenstelling tot natriumhydroxide en kaliumhydroxide, aangezien bariumcarbonaat onoplosbaar is in water..
Hierdoor kunnen indicatoren zoals fenolftaleïne of thymolftaleïne (met alkalische kleurveranderingen) worden gebruikt zonder het risico van titratiefouten veroorzaakt door de aanwezigheid van carbonaationen, die veel minder basisch zijn (Mendham, Denney, Barnes, & Thomas, 2000).
Bariumhydroxide wordt af en toe gebruikt in de organische synthese als sterke base, bijvoorbeeld voor de hydrolyse van esters en nitrilen:
Bariumhydroxide wordt ook gebruikt bij de decarboxylering van aminozuren die daarbij bariumcarbonaat vrijgeven..
Het wordt ook gebruikt bij de bereiding van cyclopentanon, diacetonalcohol en gamma-lacton D - Gulonic.
3- Katalysator in de Wittig-Horner-reactie
De Wittig-Horner-reactie, ook bekend als de Horner-Wadsworth-Emmons-reactie (of HWE-reactie) is een chemische reactie die in de organische chemie wordt gebruikt om fosfonaatcarbanionen te stabiliseren met aldehyden (of ketonen) om voornamelijk E-alkenen (trans) te produceren.
De soncochemische reactie van Wittig-Horner wordt gekatalyseerd door geactiveerd bariumhydroxide en wordt uitgevoerd onder vast-vloeistof-grensvlakomstandigheden..
Het soncochemische proces vindt plaats bij kamertemperatuur en met een lager katalysatorgewicht en lagere reactietijd dan het thermische proces. Onder deze omstandigheden worden opbrengsten verkregen die vergelijkbaar zijn met die van het thermische proces..
In het werk van (J. V. Sinisterra, 1987) wordt de invloed op de prestatie van de ultrasoonapparaattijd, het gewicht van de katalysator en het oplosmiddel geanalyseerd. Kleine hoeveelheden water moeten worden toegevoegd om de reactie te laten plaatsvinden.
De aard van de actieve plaats van de katalysator die in het proces werkt, wordt geanalyseerd. Een ETC-mechanisme wordt voorgesteld voor het sonochemische proces.
4- Andere toepassingen
Bariumhydroxide heeft andere toepassingen. Het wordt voor een aantal doeleinden gebruikt, zoals:
- De vervaardiging van alkali.
- Glazen constructie.
- Vulkanisatie van synthetisch rubber.
- Corrosieremmers.
- Zoals boorvloeistoffen, pesticiden en smeermiddelen.
- Voor het verhelpen van de ketel.
- Om plantaardige en dierlijke oliën te verfijnen.
- Voor fresco's.
- Bij waterontharding.
- Als ingrediënt in homeopathische middelen.
- Om gemorste zuur op te ruimen.
- Het wordt ook gebruikt in de suikerindustrie om bietsuiker te bereiden.
- Bouwmaterialen.
- Elektrische en elektronische producten.
- Vloerbedekkingen.
Referenties
- BARIUMHYDROXIDEMONOHYDRAAT. (2016). Hersteld van cameochemicaliën: cameochemicals.noaa.gov.
- Bariumhydroxide. (S.F.). Opgehaald van chemistrylearner: chemistrylearner.com.
- BARIUMHYDROXIDE. (S.F.). Opgehaald van chemicalland21: chemicalland21.com.
- IndiaMART InterMESH Ltd… (S.F.). Bariumhydroxide. Opgehaald van indiamart: dir.indiamart.com.
- V. Sinisterra, A. F. (1987). Ba (OH) 2 als katalysator bij organische reacties. 17. Grensvlak vast-vloeistof Wittig-Horner-reactie onder sonochemische omstandigheden. The Journal of Organic Chemistry 52 (17), 3875-3879. researchgate.net.
- Veiligheidsinformatieblad Bariumhydroxidemonohydraat. (2013, 21 mei). Opgehaald van sciencelab: sciencelab.com/msds.
- Mendham, J., Denney, R. C., Barnes, J. D., en Thomas, M. J. (2000). Vogel's kwantitatieve chemische analyse (6e ed.). New York: Prentice Hall.
- Nationaal centrum voor informatie over biotechnologie. (2017, 28 maart). PubChem samengestelde database; CID = 16211219. Opgehaald van PubChem: pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Bariumhydroxide. Opgehaald van chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Bariumhydroxidehydraat (1: 2: 1). Opgehaald van chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Dihydroxybariumhydraat (1: 1). Opgehaald van chemspider: chemspider.com.
- Royal Society of Chemistry. (2017). Endotherme vaste stof-vaste stof reacties. Hersteld van: learn-chemistry: rsc.org.



Niemand heeft nog op dit artikel gereageerd.