
IJzer (II) hydroxidestructuur, eigenschappen, gebruik
De ijzer (II) hydroxide, ook wel ferrohydroxide genoemd, het is een anorganische verbinding met de chemische formule Fe (OH)twee. Als uw zuiverheid hoog is, bestaat uw vaste stof alleen uit Fe-ionentwee+ en OH- in een verhouding van 2: 1; het kan echter watermoleculen en verschillende ionsoorten bevatten, waardoor de positie verandert.
Het vertegenwoordigt de "gereduceerde" vorm van de beroemde roest, een roodachtig oppervlak dat bestaat uit Fe-ionen.3+terwijl in groenachtige roest Fe de overhand heefttwee+, naast de OH- en andere hoeveelheid anionen: CO3twee-, SW4twee-, NIET3- en halogeniden (F-, Cl-,… ), bijvoorbeeld. Het resultaat, hoewel de basis van deze groene roest Fe (OH) istwee, is dat verschillende vaste stoffen worden verkregen.

In het dagelijks leven is dit hydroxide op gewone plaatsen te zien. Het oppervlak van de boot op de foto hierboven is bijvoorbeeld bedekt met groene roest (geen patina). Er is het geloof (OH)twee, maar vergezeld van talrijke ionen uit de golven van de zee.
Chemisch gezien zijn de eigenschappen en toepassingen van dit materiaal afhankelijk van het Fe-kation.twee+ en zijn neiging om te oxideren om het Fe te worden3+. Het is een reductiemiddel dat onder basische omstandigheden snel reageert met zuurstof. Daarom moet het worden gebruikt in inerte atmosferen en in zure oplossingen..
Artikel index
- 1 Structuur van ijzer (II) hydroxide
- 1.1 Links
- 1.2 Dubbele lagen hydroxide
- 1.3 Hydrateert
- 1.4 Groene en rode roest
- 2 Eigenschappen
- 3 toepassingen
- 3.1 Kwalitatieve organische analyse
- 3.2 Reductiemiddel voor seleniumoxoanion
- 3.3 Dubbellaagse materialen
- 4 referenties
Structuur van ijzer (II) hydroxide
Links
Beschouw alleen Fe (OH)twee puur, heeft niets dan Fe-ionentwee+ en OH-.
De interacties tussen hen moeten in theorie ionisch van aard zijn; elk Fe kationtwee+ trekt twee OH-anionen aan-, wiens niet-directionele aantrekkingskracht uiteindelijk een structurele en repetitieve orde tot stand brengt die een kristal definieert; wat op zijn beurt aanleiding geeft tot groen roeststof.
Het probleem is dat er een bepaald covalent karakter is tussen beide ionen, en daarom kan een ionische Fe-OH-binding niet worden genegeerd. Gezien een gedeeltelijk ionische Fe-OH-binding, kan worden begrepen dat ze gegroepeerd zijn in een soort polymeerlaag.
Dubbele lagen hydroxide
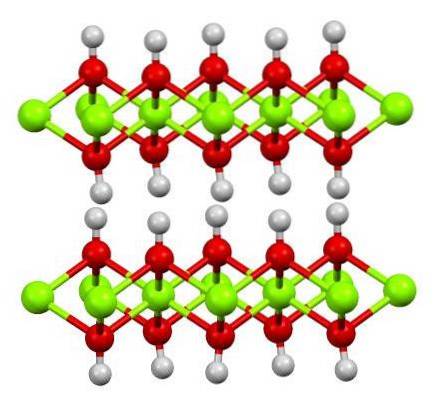
De structuur van puur ferrohydroxide is hierboven weergegeven met een ball-and-stick-model. De Fe kationentwee+ worden vertegenwoordigd door de heldergroene bollen, terwijl de OH-anionen- door de rode en witte bollen. Merk op hoe de Fe-ionen uitgelijnd zijntwee+ dankzij de interacties (ionisch-covalent) met de OH-.
Waarom wordt deze structuur dubbele hydroxidelagen genoemd? De afbeelding zelf biedt het antwoord: er zijn twee rijen of lagen OH- voor elk van Faithtwee+dat wil zeggen, de 2: 1 verhouding van Fe (OH) wordt gehandhaafdtwee vermeld aan het begin.
Structurele eenheden voor Fe (OH)twee zijn dan deze sandwiches, waar de lagen OH- ze zouden komen om de broden te vertegenwoordigen; negatief geladen broden die daarom niet goed stollen om een opvallend bruin kristal te definiëren.
Maar aan de andere kant staan de H-atomen ook op één lijn en overschaduwen ze elkaar. Als we ons het concept van polariteit en elektronegativiteit herinneren, hebben deze waterstofatomen een licht positieve partiële lading, δ +; die, hoewel zwak, een positieve zone kunnen hebben waar andere anionen of moleculen zijn ondergebracht.
Hydrateert
Wanneer de Fe (OH)twee lost op in water, zijn moleculen coördineren met het metaalcentrum van Fetwee+ om een waterig complex te vormen: [Fe (HtweeOF)4(OH)tweeDit complex heeft een octaëdrische geometrie omdat het zes liganden heeft: vier watermoleculen en twee OH-moleculen.-. In gehydrateerd ferrohydroxide is het beeld echter een beetje anders..
In het hydraat, van de hypothetische formule Fe (OH)tweeNHtweeOf, de watermoleculen bevinden zich precies tussen de twee lagen hydroxide; dat wil zeggen, ze werken door middel van dipoolionen in wisselwerking met waterstofatomen of witte bollen. Het is alsof twee OHFeOH-sandwiches worden gepakt en water wordt ingebracht om ze te groeperen: OHFeOH (HtweeO) OHFeOH.
De watermoleculen zijn zeer dynamisch, waardoor de hydraatdeeltjes geen grote afmetingen krijgen en als gevolg daarvan een colloïdale of gelatineuze vaste stof vormen..
Groene en rode roest
In hydraten hebben de hydroxidelagen afgewisselde watermoleculen; Ze kunnen echter andere anionen bevatten (al genoemd), die een grote verscheidenheid aan groene roest veroorzaken. Evenzo kunnen ze zelfs moleculen zo groot als DNA of medicijnen "vangen".
Er kunnen niet alleen Fe-ionen aanwezig zijntwee+, maar ook geloof3+, product van interne oxidatie veroorzaakt door geïntercaleerde zuurstof. Het zou zichtbaar zijn dat de groene roest (of oxide) roodachtig begint te worden naarmate de Fe-concentratie toeneemt.3+.
Eigendommen

Fe (OH) hierboven weergegeventwee neergeslagen in een reageerbuis. Omdat het in overvloedige water aanwezig is, zou complexe waterige vloeistof de zojuist genoemde structuur moeten overheersen. Merk op dat het oppervlak een oranje kleur vertoont, een product van de oxidatie van Fetwee+ tot geloof3+ door de zuurstof in de lucht; dat wil zeggen, dit hydroxide is een reductiemiddel:
Gelooftwee+ <=> Geloof3+ + en-
Het fysieke uiterlijk van deze verbinding in zijn pure staat is dat van een bruine vaste stof:

Die, afhankelijk van de vochtigheidsgraad, kan verschijnen als een geleiachtige groene vaste stof. Het is vrijwel onoplosbaar in water (Ksp= 8 10-16 en oplosbaarheid = 0,72 g / 100 ml bij 25 ° C), en heeft een molaire massa van 89,86 g / mol en een dichtheid van 3,4 g / ml.
Voor deze verbinding worden geen kook- of smeltpunten vermeld; waarschijnlijk vanwege het feit dat het vóór een warmtebron uitdroogt en wordt omgezet in ijzeroxide, FeO:
Fe (OH)twee => FeO + HtweeOF
Toepassingen
Kwalitatieve organische analyse
Het reducerende vermogen wordt gebruikt om de aanwezigheid van nitroverbindingen, RNO, te bepalentwee. De reactie waarvoor een positieve test wordt verkregen, wordt weergegeven door de volgende chemische vergelijking:
RNOtwee + 6Fe (OH)twee + 4HtweeO => RNHtwee + 6Fe (OH)3
De Fe (OH)3 slaat neer als een roodbruine vaste stof, wat de aanwezigheid van de nitrogroep -NO bevestigttwee.
Reductiemiddel voor seleniumoxoanion
Het reducerende vermogen van Fe (OH)twee het is ook gebruikt om SeO-anionen te verminderen3twee- (seleniet) en SeO4twee- (selenaat) tot elementair selenium, Se. Praktisch gezien maakt het de verwijdering mogelijk van dergelijke anionen, die schadelijk zijn voor de gezondheid, in de vorm van een onoplosbare en gemakkelijk te extraheren vaste selenium.
Dubbellaagse materialen
De pure structuur en de groene roest vormen een inspiratiebron voor het ontwerp van nieuwe materialen met mineralogische eigenschappen..
Geschat wordt dat het hun functie is om het transport van een specifieke soort tussen zijn lagen mogelijk te maken, zodat de afgifte ervan naar de actieve site (bodem, cellen, metalen oppervlak, enz.) Kan worden gecontroleerd of verminderd..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). IJzer (II) hydroxide. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2019). IJzerhydroxide. PubChem-database. CID = 10129897. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Nick Doe. (s.f.). Tests voor fenolen en nitrogroepen. Scheikunde 211. Hersteld van: academics.wellesley.edu
- Clark Jim. (27 april 2019). Chemie van ijzer. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- Kingston technische software. (2019). Rust Chemistry. Corrosie Artsen. Hersteld van: corrosie-doctors.org
- Zingaro, Ralph A. et al. (1997). Reductie van oxoseleniumanionen door ijzer (II) hydroxide. Milieu Internationaal. 23 (3): 299-304. doi: 10.1016 / S0160-4120 (97) 00032-9



Niemand heeft nog op dit artikel gereageerd.