
Histonen kenmerken, structuur, typen en functies
De histonen zijn basiseiwitten die een interactie aangaan met DNA voor de vorming van nucleosomen, die de chromatinestrengen vormen waaruit chromosomen in eukaryote organismen bestaan.
Nucleosomen, complexen die bestaan uit DNA en eiwitten, werden ontdekt in 1974 en het zijn histonen die dit basale niveau van chromatine-organisatie samenstellen. Het bestaan van histoneiwitten is echter al sinds de jaren zestig bekend..
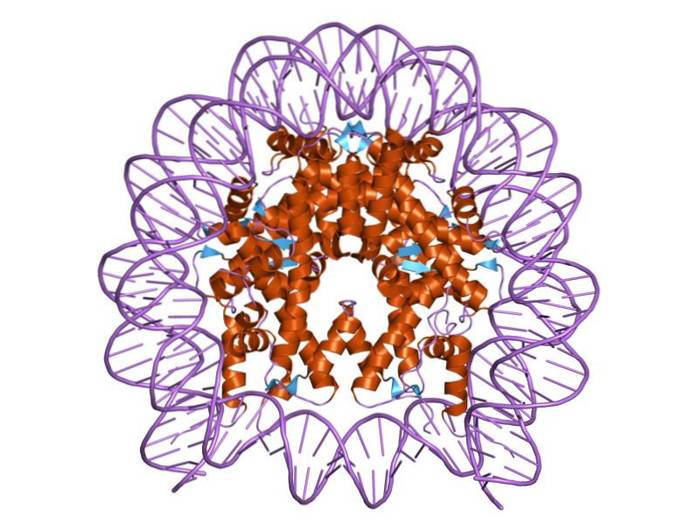
Histonen zijn zo georganiseerd dat het dubbelband-DNA zich om een eiwitcentrum wikkelt dat bestaat uit deze eiwitten die nauw met elkaar in wisselwerking staan. Het histoncentrum heeft de vorm van een schijf en het DNA gaat er ongeveer 1,7 keer omheen..
Meerdere waterstofbruggen zorgen ervoor dat DNA kan binden aan het eiwitcentrum dat wordt gevormd door de histonen in elk nucleosoom. Deze bindingen worden voor het grootste deel gevormd tussen de aminozuurruggengraat van histonen en de suiker-fosfaat-ruggengraat van DNA. Sommige hydrofobe interacties en ionische bindingen nemen ook deel.
Eiwitten die bekend staan als "chromatine-remodelleringscomplexen" zijn verantwoordelijk voor de afbraak en vorming van de verbindingsbindingen tussen DNA en histonen, waardoor de transcriptionele machinerie het DNA in de nucleosomen binnendringt..
Ondanks de nabijheid van nucleïnezuren tot het eiwitcentrum gevormd door histonen, zijn deze zo gerangschikt dat ze, indien nodig, de intrede mogelijk maken van transcriptiefactoren en andere eiwitten die verband houden met genexpressie of genuitschakeling..
Histonen kunnen verschillende modificaties ondergaan die meerdere varianten genereren, waardoor het bestaan van veel verschillende vormen van chromatine mogelijk wordt die de eigenschap hebben om genetische expressie op verschillende manieren te moduleren..
Artikel index
- 1 Kenmerken
- 2 Structuur
- 2.1 Histonen binden
- 3 soorten
- 3.1 Nucleosomale histonen
- 3.2 Histonen binden
- 4 functies
- 5 referenties
Kenmerken
Ze zijn een van de meest geconserveerde eukaryote eiwitten in de natuur. Er is bijvoorbeeld aangetoond dat erwtenhiston H4 in slechts twee van de 102 aminozuurposities van het koe-H4-eiwit verschilt..
Histonen zijn relatief kleine eiwitten, met niet meer dan 140 aminozuren. Ze zijn rijk aan basische aminozuurresiduen, dus ze hebben een netto positieve lading, wat bijdraagt aan hun interactie met het negatief geladen nucleïnezuur om nucleosomen te vormen..
Nucleosomale en overbruggende histonen zijn bekend. De nucleosomale histonen zijn H3, H4, H2A en H2B, terwijl de bindende histonen behoren tot de familie van histonen H1.
Tijdens nucleosoomassemblage worden aanvankelijk specifieke dimeren H3-H4 en H2A-H2B gevormd. Twee H3-H4-dimeren komen dan samen om tetrameren te vormen die later worden gecombineerd met de H2A-H2B-dimeren, waardoor het octamere centrum wordt gevormd..
Alle histonen worden voornamelijk gesynthetiseerd tijdens de S-fase van de celcyclus, en nucleosomen worden geassembleerd in de ontluikende DNA-helices, net na de replicatievork..
Structuur
De algemene structuur van histonen omvat een basisch aminozuurgebied en een bolvormig carboxylgebied dat sterk geconserveerd is onder eukaryote organismen..
Een structureel motief dat bekend staat als "histonvouw", bestaande uit drie alfa-helices verbonden door twee haarspelden en die een klein hydrofoob centrum vormen, is verantwoordelijk voor de proteïne-proteïne-interacties tussen de histonen waaruit het nucleosoom bestaat..
Het is deze vouw van histonen die het globulaire carboxyldomein vormt van deze nucleosomale eiwitten in alle eukaryoten..
Histonen hebben ook kleine "staarten" of amino-terminale en andere carboxyl-terminale gebieden (toegankelijk voor proteasen), niet langer dan 40 aminozuren. Beide regio's zijn rijk aan basische aminozuren die meerdere posttranslationele covalente modificaties kunnen ondergaan..
Histonen binden
In eukaryoten zijn er twee families van bindende histonen, die van elkaar verschillen door hun structuur. Sommige hebben een tripartiete structuur, waarbij het hierboven beschreven globulaire domein wordt geflankeerd door "ongestructureerde" N- en C-terminale domeinen; terwijl anderen alleen een C-terminaal domein hebben.
Hoewel de meeste histonen geconserveerd zijn, kunnen in sommige organismen specifieke varianten ontstaan tijdens de embryogenese of de rijping van gespecialiseerde cellen. Sommige structurele variaties hebben te maken met post-translationele wijzigingen, zoals de volgende:
-Fosforylering: er wordt gedacht dat het verband houdt met de wijziging van de condensatiegraad van chromatine en het komt vaak voor in serineresiduen.
-Acetylering: geassocieerd met chromosomale regio's die transcriptioneel actief zijn. Het komt normaal voor op de zijketens van lysineresiduen. Wanneer ze op deze residuen voorkomen, neemt hun positieve lading af, waardoor de affiniteit van eiwitten voor DNA afneemt..
-Methylering: kan optreden als mono-, di- of trimethylering van lysineresiduen die uit de eiwitkern steken.
Specifieke enzymen zijn verantwoordelijk voor deze covalente modificaties in histonen. Deze enzymen omvatten histon-acetyltransferasen (HAT's), histon-deacetylasen-complexen (HDAC's) en histon-methyltransferasen en demethylasen..
Types
De karakterisering van de histonen is uitgevoerd met verschillende biochemische technieken, waaronder de chromatografieën die zijn gebaseerd op zwakke kationenuitwisselingsharsen..
Bepaalde auteurs stellen een vorm van classificatie vast waarin 5 hoofdtypen histonen worden onderscheiden in eukaryoten: FI, met 21 kDa-eiwitten; F2A1 of FIV, van plus of min 11,3 kDa; F2A2 of FIIbI, 14,5 kDa; F2B of FIIb2, met een molecuulgewicht van 13,7 kDa, en F3 of FIII, van 15,3 kDa.
Al deze soorten histonen, met uitzondering van de IF-groep, worden in equimolaire hoeveelheden in cellen aangetroffen..
Een andere classificatie, met dezelfde geldigheid en misschien wel de meest gebruikte vandaag, stelt het bestaan van twee verschillende soorten histonen voor, namelijk: degene die deel uitmaken van de octameer van het nucleosoom en de bindende of overbruggende histonen, die de nucleosomen verbinden tussen Ja.
Sommige varianten kunnen ook voorkomen tussen soorten en in tegenstelling tot kernhistonen, worden varianten gesynthetiseerd tijdens interfase en worden ze ingebracht in het voorgevormde chromatine via een proces dat afhankelijk is van de energie die vrijkomt bij ATP-hydrolyse..
Nucleosomale histonen
Het centrum van een nucleosoom bestaat uit een paar van elk van de vier samenstellende histonen: H2a, H2b, H3 en H4; waarop DNA-segmenten van ongeveer 145 basenparen zijn gewikkeld.
Histonen H4 en H2B zijn in principe onveranderlijk. Sommige variaties zijn echter duidelijk in histonen H3 en H2A, waarvan de biofysische en biochemische eigenschappen de normale aard van het nucleosoom veranderen..
Een variant van histon H2A bij mensen, het H2A.Z-eiwit heeft een groot zuur gebied en kan de nucleosoomstabiliteit bevorderen, afhankelijk van de histon H3-varianten waarmee het is geassocieerd..
Deze histonen vertonen een zekere variabiliteit tussen soorten, een speciaal geval is dat van histon H2B, waarvoor het eerste derde deel van het molecuul zeer variabel is..
Histonen binden
De bindende of overbruggende histonen zijn klasse H1-histonen. Deze zijn verantwoordelijk voor de vereniging tussen nucleosomen en de bescherming van het DNA dat aan het begin en aan het einde van elk deeltje uitsteekt..
In tegenstelling tot nucleosomale histonen, bezitten niet alle H1-type histonen het bolvormige gebied van de histonvouw. Deze eiwitten binden aan DNA tussen nucleosomen, waardoor een verschuiving in de chromatinebalans naar een meer gecondenseerde en minder actieve toestand transcriptioneel mogelijk wordt..
Studies hebben deze histonen in verband gebracht met veroudering, DNA-herstel en apoptotische processen, en daarom wordt aangenomen dat ze een cruciale rol spelen bij het handhaven van de genomische integriteit..
Kenmerken
Alle aminozuurresiduen van histonen nemen op de een of andere manier deel aan hun interactie met DNA, wat verklaart dat ze zo geconserveerd zijn in de koninkrijken van eukaryote organismen..
De deelname van histonen aan het verpakken van DNA in de vorm van chromatine is van groot belang voor complexe meercellige organismen waarin de verschillende cellijnen zich alleen kunnen specialiseren door de toegankelijkheid van hun genen tot de transcriptionele machinerie te veranderen..
Transcriptioneel actieve genomische regio's zijn dicht in nucleosomen, wat suggereert dat de associatie van DNA met histoneiwitten cruciaal is voor de negatieve of positieve regulatie van hun transcriptie..
Evenzo hangt gedurende de levensduur van een cel de respons op een groot aantal stimuli, zowel intern als extern, af van kleine veranderingen in chromatine, die normaal gesproken te maken hebben met hermodellering en posttranslationele modificatie van de histonen die in nauwe relatie met DNA.
Meerdere histonvariabelen hebben verschillende functies in eukaryoten. Een daarvan heeft te maken met de deelname van een variant van histon H3 aan de vorming van de centromere structuren die verantwoordelijk zijn voor de scheiding van chromosomen tijdens mitose..
Van de tegenhanger van dit eiwit in andere eukaryoten is aangetoond dat het essentieel is voor de assemblage van de eiwitkinetochoor waaraan microtubuli in de spil binden tijdens mitose en meiose..
Referenties
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P. (2015). Moleculaire biologie van de cel (6e ed.). New York: Garland Science.
- Campos, E. I., en Reinberg, D. (2009). Histonen: annoteren van chromatine. Annu. Rev. Genet., 43, 559-599.
- Harvey, A. C., en Downs, J. A. (2004). Welke functies bieden linkerhistonen? Moleculaire microbiologie, 53, 771-775.
- Henikoff, S., en Ahmad, K. (2005). Assemblage van varianthistonen in chromatine. Annu. Rev. Cell. Dev Biol., eenentwintig, 133-153.
- Isenberg, I. (1979). Histonen. Annu. Rev. Biochem., 48, 159-191.
- Kornberg, R. D., en Thomas, J. O. (1974). Chromatinestructuur: oligomeren van de histonen. Wetenschap, 184(4139), 865-868.
- Smith, E., DeLange, R., & Bonner, J. (1970). Chemie en biologie van de histonen. Fysiologische beoordelingen, vijftig(2), 159-170.


Niemand heeft nog op dit artikel gereageerd.