
Immunoglobulinen Structuur, typen en functies
De immunoglobulinen Het zijn moleculen die B-lymfocyten en plasmacellen maken die samenwerken met de verdediging van het lichaam. Ze bestaan uit een glycoproteïne-biomolecuul dat tot het immuunsysteem behoort. Ze zijn een van de meest voorkomende eiwitten in bloedserum, na albumine.
Antilichaam is een andere naam voor immunoglobulinen en ze worden als globulinen beschouwd vanwege hun gedrag bij de elektroforese van het bloedserum dat ze bevat. Het immunoglobulinemolecuul kan eenvoudig of complex zijn, afhankelijk van of het wordt gepresenteerd als een monomeer of dat het gepolymeriseerd is..

De algemene structuur van immunoglobulinen is vergelijkbaar met de letter "Y". Er zijn vijf soorten immunoglobulinen die morfologische, functionele en locatieverschillen in het lichaam vertonen. De structurele verschillen van antilichamen zijn niet in vorm, maar in samenstelling; elk type heeft een specifiek doel.
De immuunrespons die door immunoglobulinen wordt bevorderd, is zeer specifiek en is een zeer complex mechanisme. De prikkel voor de uitscheiding door cellen wordt geactiveerd in aanwezigheid van lichaamsvreemde stoffen, zoals bacteriën. De functie van het immunoglobuline zal zijn om aan het vreemde element te binden en het te elimineren.
Immunoglobulinen of antilichamen kunnen zowel in het bloed als op het vliezige oppervlak van de organen aanwezig zijn. Deze biomoleculen vertegenwoordigen belangrijke elementen binnen het afweersysteem van het menselijk lichaam..
Artikel index
- 1 Structuur
- 1.1 Zware ketens
- 1.2 Lichte ketens
- 1.3 Segmenten Fc en Fab
- 2 soorten
- 2.1 Immunoglobuline G (IgG)
- 2.2 Immunoglobuline M (IgM)
- 2.3 Immunoglobuline A (IgA)
- 2.4 Immunoglobuline E (IgE)
- 2.5 Immunoglobuline D (IgD)
- 2.6 Type wijziging
- 3 functies
- 3.1 Algemene functies
- 3.2 Specifieke functies
- 4 referenties
Structuur
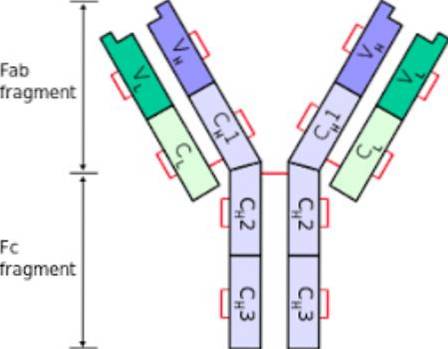
De structuur van antilichamen bevat aminozuren en koolhydraten, de oligosacchariden. De overheersende aanwezigheid van aminozuren, hun hoeveelheid en distributie is wat de structuur van het immunoglobuline bepaalt..
Zoals alle eiwitten hebben immunoglobulinen primaire, secundaire, tertiaire en quaternaire structuren, die hun typische uiterlijk bepalen..
Wat betreft het aantal aminozuren dat ze bevatten, hebben immunoglobulinen twee soorten ketens: zware keten en lichte keten. Bovendien heeft elk van de ketens, volgens de aminozuursequentie in zijn structuur, een variabel gebied en een constant gebied..
Zware kettingen
De zware ketens van immunoglobulinen komen overeen met polypeptide-eenheden die zijn opgebouwd uit sequenties van 440 aminozuren..
Elk immunoglobuline heeft 2 zware ketens, en elk van deze heeft op zijn beurt een variabel gebied en een constant gebied. Het constante gebied heeft 330 aminozuren en van de variabele 110 aminozuren is de sequentie bepaald.
De structuur van de zware keten is voor elke immunoglobuline anders. Er zijn in totaal 5 soorten zware ketens die de soorten immunoglobuline bepalen.
Zware ketensoorten worden geïdentificeerd door de Griekse letters γ, μ, α, ε, δ voor respectievelijk immunoglobulinen IgG, IgM, IgA, IgE en IgD..
Het constante gebied van de zware ketens ε en μ wordt gevormd door vier domeinen, terwijl die corresponderen met α, γ, δ er drie hebben. Elk constant gebied zal dan verschillend zijn voor elk type immunoglobuline, maar gemeenschappelijk voor immunoglobulinen van hetzelfde type..
Het variabele gebied van de zware keten bestaat uit een enkel immunoglobulinedomein. Dit gebied heeft een sequentie van 110 aminozuren en zal verschillen afhankelijk van de specificiteit van het antilichaam voor een antigeen..
In de structuur van zware kettingen kan een hoeking of buiging worden waargenomen - een scharnier genaamd - die het flexibele gedeelte van de ketting vertegenwoordigt.
Lichte kettingen
Lichte ketens van immunoglobuline zijn polypeptiden die uit ongeveer 220 aminozuren bestaan. Er zijn twee soorten lichte ketens bij mensen: kappa (κ) en lambda (λ), de laatste met vier subtypes. De constante en variabele domeinen hebben sequenties van elk 110 aminozuren..
Een antilichaam kan twee κ (κκ) lichte ketens of een paar λ (λλ) -ketens hebben, maar het is niet mogelijk dat het tegelijkertijd een van elk type bezit.
Segmenten Fc en Fab
Aangezien elk immunoglobuline de vorm van een "Y" heeft, kan het in twee segmenten worden verdeeld. Het "onderste" segment, de base, wordt de kristalliseerbare fractie of Fc genoemd; terwijl de armen van de "Y" het Fab vormen, of fractie die aan het antigeen bindt. Elk van deze structurele secties van immunoglobuline vervult een andere functie..
Segment Fc
Het Fc-segment heeft twee of drie constante domeinen van zware ketens van immunoglobuline.
Fc kan binden aan eiwitten of een specifieke receptor op basofielen, eosinofielen of mestcellen, waardoor de specifieke immuunrespons wordt opgewekt die het antigeen zal elimineren. Fc komt overeen met het carboxyl-uiteinde van immunoglobuline.
Fantastisch segment
De Fab-fractie of -segment van een antilichaam bevat de variabele domeinen aan de uiteinden, naast de constante domeinen van de zware en lichte ketens.
Het constante domein van de zware keten wordt voortgezet waarbij de domeinen van het Fc-segment het scharnier vormen. Komt overeen met het amino-terminale uiteinde van immunoglobuline.
Het belang van het Fab-segment is dat het binding met antigenen, vreemde en potentieel schadelijke stoffen mogelijk maakt.
De variabele domeinen van elk immunoglobuline garanderen zijn specificiteit voor een bepaald antigeen; dit kenmerk maakt het zelfs mogelijk om het te gebruiken bij de diagnose van ontstekings- en infectieziekten.
Types

De tot dusver bekende immunoglobulinen hebben een specifieke zware keten die voor elk van deze constant is en verschilt van de andere..
Er zijn vijf soorten zware ketens die vijf soorten immunoglobulinen bepalen, waarvan de functies verschillen.
Immunoglobuline G (IgG)
Immunoglobuline G is de meest talrijke variëteit. Het heeft een zware gamma-keten en komt voor in unimoleculaire of monomere vorm.
IgG komt het meest voor in zowel bloedserum als weefselruimte. Minimale veranderingen in de aminozuursequentie van de zware keten bepalen de indeling in subtypen: 1, 2, 3 en 4.
Immunoglobuline G heeft een sequentie van 330 aminozuren in zijn Fc-segment en een molecuulgewicht van 150.000, waarvan 105.000 overeenkomen met de zware keten.
Immunoglobuline M (IgM)
Immunoglobuline M is een pentameer waarvan de zware keten μ is. Het molecuulgewicht is hoog, ongeveer 900.000.
De aminozuursequentie van zijn zware keten is 440 in zijn Fc-fractie. Het wordt voornamelijk aangetroffen in bloedserum en vertegenwoordigt 10 tot 12% van de immunoglobulinen. IgM heeft maar één subtype.
Immunoglobuline A (IgA)
Het komt overeen met het type α van de zware keten en vertegenwoordigt 15% van de totale immunoglobulinen. IgA wordt zowel in bloed als in secreties aangetroffen, zelfs in moedermelk, en presenteert zich in de vorm van een monomeer of dimeer. Het molecuulgewicht van dit immunoglobuline is 320.000 en het heeft twee subtypes: IgA1 en IgA2..
Immunoglobuline E (IgE)
Immunoglobuline E bestaat uit de ε-type zware keten en is zeer schaars in serum, ongeveer 0,002%.
IgE heeft een molecuulgewicht van 200.000 en is als monomeer voornamelijk aanwezig in serum, neusslijm en speeksel. Het is ook gebruikelijk om dit immunoglobuline te vinden in basofielen en mestcellen..
Immunoglobuline D (IgD)
De variant van de zware keten δ komt overeen met immunoglobuline D, dat 0,2% van de totale immunoglobulinen vertegenwoordigt. IgD heeft een molecuulgewicht van 180.000 en is gestructureerd als een monomeer.
Het is gerelateerd aan B-lymfocyten, gehecht aan hun oppervlak. De rol van IgD is echter onduidelijk.
Verandering van type
Immunoglobulinen kunnen een structurele verandering van type ondergaan vanwege de noodzaak om zich te verdedigen tegen een antigeen.
Deze verandering is te wijten aan de rol van B-lymfocyten bij het maken van antilichamen door de eigenschap van adaptieve immuniteit. De structurele verandering bevindt zich in het constante gebied van de zware keten, zonder het variabele gebied te wijzigen.
Een verandering van type of klasse kan ervoor zorgen dat een IgM verandert in IgG of IgE, en dit gebeurt als een reactie die wordt geïnduceerd door interferon-gamma of interleukines IL-4 en IL-5.
Kenmerken
De rol die immunoglobulinen spelen in het immuunsysteem is van vitaal belang voor de afweer van het lichaam.
Immunoglobulinen maken deel uit van het humorale immuunsysteem; dat wil zeggen, het zijn stoffen die door cellen worden uitgescheiden ter bescherming tegen pathogenen of schadelijke agentia.
Ze bieden een effectief verdedigingsmiddel, effectief, specifiek en gesystematiseerd, en zijn van grote waarde als onderdeel van het immuunsysteem. Ze hebben algemene en specifieke functies binnen immuniteit:
Algemene functies
Antilichamen of immunoglobulinen vervullen zowel onafhankelijke functies als het activeren van celgemedieerde effector- en secretoire reacties.
Antigeen-antilichaambinding
Immunoglobulinen hebben de functie om antigene middelen specifiek en selectief te binden.
De vorming van het antigeen-antilichaamcomplex is de belangrijkste functie van een immunoglobuline en daarom is het de immuunrespons die de werking van het antigeen kan stoppen. Elk antilichaam kan tegelijkertijd aan twee of meer antigenen binden.
Effector-functies
Meestal dient het antigeen-antilichaam-complex als de initiator om specifieke cellulaire reacties te activeren of om een reeks gebeurtenissen op gang te brengen die de eliminatie van het antigeen bepalen. De twee meest voorkomende effectorreacties zijn celbinding en complementactivering..
Celbinding hangt af van de aanwezigheid van specifieke receptoren voor het Fc-segment van het immunoglobuline, als het eenmaal aan het antigeen is gebonden.
Cellen zoals mestcellen, eosinofielen, basofielen, lymfocyten en fagocyten bezitten deze receptoren en verschaffen de mechanismen voor de eliminatie van antigeen..
De activering van de complementcascade is een complex mechanisme waarbij het begin van een reeks betrokken is, dus het eindresultaat is de afscheiding van giftige stoffen die antigenen elimineren.
Specifieke functies
Ten eerste ontwikkelt elk type immunoglobuline een specifieke verdedigingsfunctie:
Immunoglobuline G
- Immunoglobuline G biedt de meeste afweer tegen antigene middelen, waaronder bacteriën en virussen.
- IgG activeert mechanismen zoals complement en fagocytose.
- Antigeen-specifieke IgG-samenstelling is duurzaam.
- Het enige antilichaam dat de moeder tijdens de zwangerschap aan haar kinderen kan overdragen, is IgG.
Immunoglobuline M
- IgM is het snel reagerende antilichaam tegen schadelijke en infectieuze agentia, omdat het onmiddellijke actie geeft totdat het wordt vervangen door IgG.
- Dit antilichaam activeert cellulaire reacties die zijn opgenomen in het lymfocytmembraan en humorale reacties zoals complement..
- Het is de eerste immunoglobuline die door mensen wordt gesynthetiseerd.
Immunoglobuline A
- Het fungeert als een verdedigingsbarrière tegen ziekteverwekkers, doordat het zich op de oppervlakken van de slijmvliezen bevindt.
- Het is aanwezig in het ademhalingsslijmvlies, het spijsverteringsstelsel, de urinewegen en ook in secreties zoals speeksel, neusslijm en tranen..
- Hoewel de complementactivering ervan laag is, kan het worden geassocieerd met lysozymen om bacteriën te doden.
- Door de aanwezigheid van immunoglobuline D in zowel moedermelk als biest kan een pasgeborene het krijgen tijdens het geven van borstvoeding.
Immunoglobuline E
- Immunoglobuline E biedt een sterk afweermechanisme tegen allergie-producerende antigenen.
- De interactie tussen IgE en een allergeen veroorzaakt ontstekingsstoffen die verantwoordelijk zijn voor de symptomen van allergieën, zoals niezen, hoesten, netelroos, meer tranen en neusslijm..
- IgE kan zich ook hechten aan het oppervlak van parasieten via zijn Fc-segment, waardoor een reactie ontstaat die hun dood veroorzaakt..
Immunoglobuline D
- De monomere structuur van IgD is gebonden aan B-lymfocyten die geen interactie hebben gehad met antigenen, dus spelen ze de rol van receptoren.
- De rol van IgD is onduidelijk.
Referenties
- (s.f.) Medische definitie van immunoglobuline. Opgehaald van medicinenet.com
- Wikipedia (s.f.). Antilichaam. Opgehaald van en.wikipedia.org
- Grattendick, K., Pross, S. (2007). Immunoglobulinen. Opgehaald van sciencedirect.com
- Iáñez, E. (s.f.). Immunoglobulinen en andere B-celmoleculen Cursus algemene immunologie. Hersteld van ugr.es
- (s.f.) Inleiding tot immunoglobulinen. Opgehaald van thermofisher.com
- Buddiga, P. (2013). Immuunsysteem anatomie. Opgehaald van emedicine.medscape.com
- Biochemische vragen (2009). Immunoglobulinen: structuur en functies. Opgehaald van biochemistryquestions.wordpress.com
- (s.f.) Immunoglobulinen - structuur en functie. Opgehaald van microbiologybook.org



Niemand heeft nog op dit artikel gereageerd.