
Medium MIO foundation, voorbereiding en gebruik
De half MIO is een biochemische test die wordt gebruikt om te helpen bij de identificatie van bacteriesoorten die tot de Enterobacteriaceae-familie behoren. Het is vrij voedzaam en is samengesteld uit glucose, gistextract, pepton, tripteïne, L-ornithinehydrochloride, broomcresolpurper en agar.
De betekenis van het acroniem (MIO) beschrijft elk van de parameters die in dit medium kunnen worden waargenomen; beweeglijkheid, indool en ornithine. Motiliteit is het vermogen van het micro-organisme om te bewegen door de aanwezigheid van flagellen. Om deze eigenschap in acht te nemen, moet de consistentie van het medium halfvast zijn, zodat het preparaat minder agar bevat..
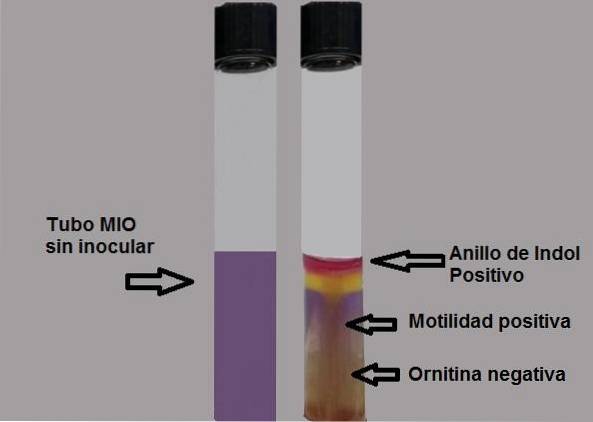
De productie van indol toont de aanwezigheid aan van het enzym tryptofanase dat inwerkt op het aminozuur tryptofaan, waardoor het gebruik van een onthullend reagens nodig is om de productie van indol zichtbaar te maken..
Ten slotte bepaalt ornithine of de bacterie in staat is om het aminozuur te decarboxyleren, dat wil zeggen, of het het enzym orinithine decarboxylase heeft..
Artikel index
- 1 Grondgedachte
- 1.1 Pepton, gistextract en tripteïne
- 1.2 Motiliteit
- 1.3 Glucose
- 1.4 L-Ornithine
- 1,5 pH-indicator
- 2 Zaai- en ontwikkeltechniek
- 3 Voorbereiding
- 3.1 MIO-medium
- 3.2 Kovacs-reagens (indooltestontwikkelaar)
- 4 Gebruik
- 5 Kwaliteitscontrole
- 6 referenties
Basis
Pepton, gistextract en tripteïne
Deze elementen dragen bij aan de voedingskracht van dit medium. Ze dienen als een bron van voedingsstoffen en essentiële aminozuren voor de ontwikkeling van bacteriën.
Bovendien is tripteïne een bron van tryptofaan om de aanwezigheid van het enzym tryptofanase aan te tonen, dat tryptofaan afbreekt door reductieve deaminering, waarbij indool, pyrodruivenzuur, ammoniak en energie vrijkomen..
Indool is kleurloos, daarom wordt de aanwezigheid ervan onthuld door vijf druppels Ehrlich- of Kovacs-reagens toe te voegen, beide met p-dimethylaminobenzaldehyde..
De aldehydegroep van deze verbinding reageert met indool en genereert een ringvormig, fuchsia-rood product op het oppervlak van de agar..
Elk spoor van kleur moet als een positieve test worden beschouwd. De proef moet onmiddellijk worden gelezen, omdat de kleur na verloop van tijd afneemt.
Bovendien moet deze test worden onthuld nadat de motiliteits- en decarboxyleringsresultaten van ornithine zijn genoteerd..
Interpretatie
Positieve test: vorming van een fuchsia-rode ring bij het toevoegen van druppels Kovacs-reagens.
Negatieve test: geen ringvorming.
Beweeglijkheid
Het vermogen van de bacteriën om te bewegen zal worden aangetoond als een troebel medium wordt waargenomen of als er een dikke groeilijn is die rond de eerste inoculatie uitzet..
Een negatieve motiliteitstest zal worden aangetoond door een dunne lijn van groei te observeren, en alles eromheen zal zonder groei zijn..
Het is belangrijk dat de beweeglijkheid wordt gelezen voordat de indool wordt onthuld, aangezien de toevoeging van het reagens het hele medium vertroebelt..
Bij mobiele maar langzaam groeiende bacteriën is het moeilijk om hun beweeglijkheid met dit medium aan te tonen. In dit geval wordt aanbevolen om andere tests of methoden te gebruiken, zoals de gemiddelde beweeglijkheid of de drop-pending-methode..
Glucose
Glucose is het fermenteerbare koolhydraat dat, naast het leveren van energie, het milieu verzuurt, een noodzakelijke voorwaarde voor de decarboxylering van het aminozuur ornithine..
Glucosefermentatie moet altijd plaatsvinden, uitgaande van het principe dat alle bacteriën die tot de Enterobacteriaceae-familie behoren, glucose fermenteren..
L-Ornithine
In het geval dat de bacteriën het enzym ornithine decarboxylase produceren, kan dit optreden zodra het medium is aangezuurd door de fermentatie van glucose..
Het enzym ornithine decarboxylase werkt in op de carboxylgroep van het aminozuur en produceert een amine genaamd putresine dat het medium weer alkaliseert.
Deze test moet na 24 uur incubatie worden gelezen, want als u eerder probeert te lezen, kunt u de test verkeerd interpreteren met een vals-negatief.
Er moet aan worden herinnerd dat de eerste reactie die optreedt de fermentatie van glucose is, daarom wordt het medium in een beginfase geel (eerste 10 tot 12 uur). Als vervolgens ornithinedecarboxylering optreedt, wordt het medium paars.
Het is belangrijk om de ornithine-decarboxyleringstest te interpreteren voordat indool wordt onthuld, aangezien de toevoeging van Kovacs 'reagens de kleur van het medium verandert..
Interpretatie
Negatieve test: gele medium of gele achtergrond.
Positieve test: half helemaal paars.
PH-indicator
In dit geval wordt broomcresolpaars gebruikt; degene die verantwoordelijk is voor het onthullen wanneer er een verandering in pH in het medium is. Bij verzuring wordt de indicator geel en bij alkalisch maken wordt hij paars.
Zaai- en ontwikkeltechniek
Om het MIO-medium te zaaien, wordt een rechte lus of naald gebruikt en daarmee wordt een deel van de te bestuderen kolonie verzameld..
In het midden van MIO wordt in een rechte lijn een diepe punctie gemaakt. Het is niet aan te raden om een dubbele punctie uit te voeren, omdat dit een verkeerd beeld van de beweeglijkheid kan geven als de lekke banden niet op dezelfde plaats worden uitgevoerd.
Incubeer gedurende 24 tot 48 uur bij 37 ° C in aerobiose. Bekijk de resultaten in deze volgorde: beweeglijkheid, decarboxylering van de ornithine en onthul tenslotte de indool.
Het is raadzaam om aseptisch 2 ml van het medium te verwijderen, het over te brengen naar een steriel buisje en daar de indooltest uit te voeren, zodat als het negatief is, de rest van het originele buisje nog eens 24 uur kan worden geïncubeerd om de indole opnieuw..
De ontwikkeling van het indool wordt als volgt uitgevoerd: 3 tot 5 druppels Kovacs-reagens worden aan het MIO-medium toegevoegd en het wordt krachtig geschud. Er wordt gekeken of er al dan niet een rode fuchsia ring verschijnt.
Voorbereiding
Middelgrote MIO
Weeg 31 g van het MIO-medium af en los op in een liter gedestilleerd water..
Verhit tot het mengsel een minuut kookt en schud regelmatig totdat de agar volledig is opgelost. Verdeel 4 ml van het medium in 13/100 reageerbuisjes met katoenen dop.
Steriliseer gedurende 15 minuten in autoclaaf bij 121 ° C. Haal uit de autoclaaf en laat rechtop in een rek staan, zodanig dat er een halfvast blok ontstaat.
Bewaren in de koelkast 2-8 ° C. Laat opwarmen voordat u de bacteriestam zaait.
De kleur van het gedehydrateerde medium is beige en die van het bereide medium licht opaalachtig paars..
De uiteindelijke pH van het bereide medium is 6,5 ± 0,2
Het medium wordt geel bij zure pH en is paars bij alkalische pH.
Kovacs-reagens (ontwikkelaar van indooltests)
Dit reagens wordt als volgt bereid:
Er wordt 150 ml amyl-, isoamyl- of butylalcohol (een van de drie) afgemeten. Daarin wordt 10 g p-dimethylaminobenzaldehyde opgelost. Vervolgens wordt langzaam 50 ml geconcentreerd zoutzuur toegevoegd..
Het bereide reagens is kleurloos of lichtgeel. Het moet in een amberkleurige fles worden bewaard en in de koelkast worden bewaard. Een donkerbruine kleur toont zijn achteruitgang.
Ook kan het Kovacs-reagens worden vervangen door het Ehrlich-reagens. De laatste, die gevoeliger is, heeft de voorkeur om indool te onthullen in bacteriën die het in zeer kleine hoeveelheden produceren, zoals in sommige niet-fermenterende gramnegatieve staafjes en bepaalde anaëroben..
Gebruik
Dit medium is een test die een aanvulling vormt op een reeks biochemische tests voor de identificatie van bacteriën die behoren tot de Enterobacteriaceae-familie..
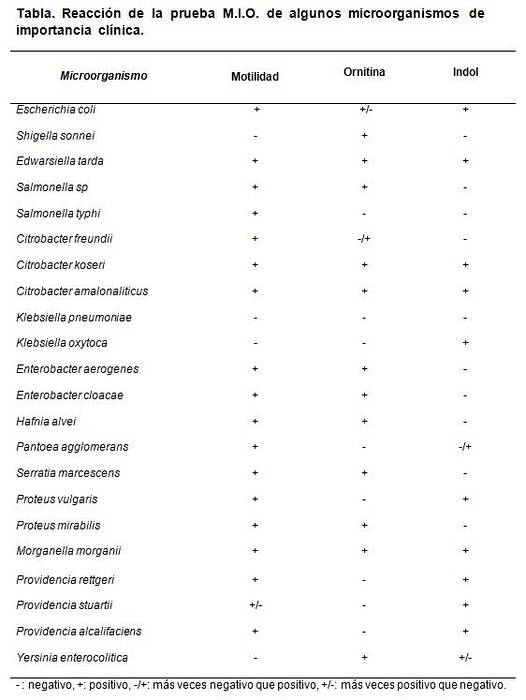
De gegevens van de decarboxylering van ornithine dienen om onderscheid te maken tussen Shigella sonnei, dat geeft positief, van Shigella boydii, Shigella flexneri en S. dysenterieae, die negatieven geven.
Het onderscheidt ook het geslacht Klebsiella, dat negatief test, van het geslacht Enterobacter, waar de meeste van zijn soorten positief testen..
QA
Elke keer dat een batch MIO-medium wordt bereid, kan een controletest worden uitgevoerd. Hiervoor worden bekende of gecertificeerde stammen gebruikt om het gedrag van het medium te observeren..
De soorten die kunnen worden gebruikt zijn Escherichia coli, Morganella morganii, Klebsiella pneumoniae, Enterobacter aerogenes Y Proteus mirabilis.
De verwachte resultaten zijn E. coli en M. morganii. Dan M: +, I: + en O: +.
Klebsiella pneumoniae geeft alle negatieve (M: -, I: -, O :-). Proteus mirabilis Y Enterobacter aerogenes geef M: + I: - en O: +.
Referenties
- Mac Faddin J. (2003). Biochemische tests voor de identificatie van bacteriën van klinisch belang. 3e ed. Redactioneel Panamericana. Buenos Aires. Argentinië.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott Microbiologische diagnose. 12 ed. Redactioneel Panamericana S.A. Argentinië.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. 5e druk. Redactioneel Panamericana S.A. Argentinië.
- Britannia Laboratories. MIO Medio 2015 Beschikbaar op: britanialab.com
- BD Laboratoria. BBL Motiliteit Indole Ornithine (MIO) Medium. 2007. Beschikbaar op: bd.com
- Valtek Laboratoria. Middelgrote M.I.O. Motiliteit, Indool, Ornithine. 2010 Beschikbaar op: andinamedica.com

Niemand heeft nog op dit artikel gereageerd.