
Metalloproteïnases kenmerken, functies en typen
De metalloproteïnases of metalloproteasen zijn enzymen die eiwitten afbreken en die de aanwezigheid van een metaalatoom nodig hebben om activiteit te hebben. De uitvoerende arm van alle activiteiten die door een cel worden uitgevoerd, zijn enzymen.
Hoewel veel eiwitten een structurele rol spelen, hebben een groot aantal, zo niet de meeste, enige katalytische activiteit. Een groep van deze enzymen is verantwoordelijk voor het afbreken van andere eiwitten.
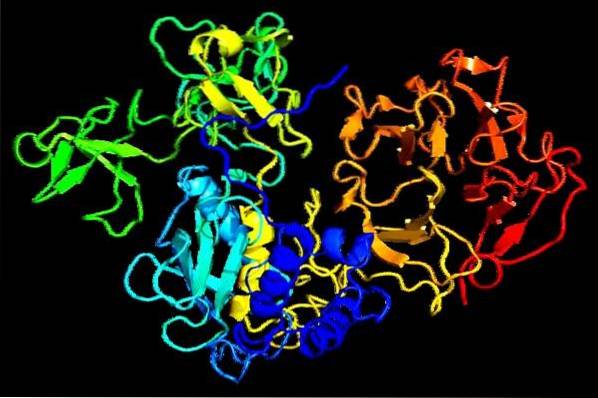
Gezamenlijk worden deze enzymen proteïnasen of proteasen genoemd. De groep proteasen die een metaalatoom nodig hebben om actief te zijn, worden metalloproteïnasen genoemd.
Artikel index
- 1 Functies
- 2 Algemene kenmerken van metalloproteïnasen
- 3 Classificatie
- 3.1-Metaloproteïnasen exopeptidasen
- 3.2-Metaloproteïnases endopeptidasen
- 4 Overige functies en wijzigingen
- 4.1 Eiwitmodificatie
- 4.2 Gezondheidseffecten
- 5 Bijbehorende pathologieën
- 6 Therapeutische toepassingen
- 7 referenties
Kenmerken
Proteasen vervullen over het algemeen een belangrijke en talrijke groep taken in een cel. De meest wereldwijde taak is om de omzetting van eiwitten in een cel mogelijk te maken.
Dat wil zeggen, verwijder oude eiwitten en laat ze vervangen door nieuwe eiwitten. Er worden nieuwe eiwitten aangemaakt de novo op ribosomen tijdens het vertaalproces.
Met name de belangrijkste rol van metalloproteïnasen is het reguleren van celgedrag. Dit wordt bereikt door deze specifieke groep proteasen door de aanwezigheid en de tijd van aanwezigheid van transcriptieregulatoren, responsmediatoren, receptoren, structurele membraaneiwitten en interne organellen, enz..
Afhankelijk van hun wijze van afbraak worden proteasen, inclusief metalloproteïnasen, ingedeeld in endoproteasen (metallo-endoproteasen) of exoproteasen (metalloexoproteasen)..
De eerste breken eiwitten af van het ene uiteinde van het eiwit (dwz amino of carboxyl). Endoproteasen daarentegen maken met een bepaalde specificiteit insnijdingen in het eiwit.
Algemene kenmerken van metalloproteïnasen
Metalloproteïnases zijn misschien wel de meest diverse groep proteasen van de zes die er bestaan. Proteasen worden geclassificeerd volgens hun katalytische mechanisme. Deze groepen zijn de proteasen van cysteïne, serine, threonine, asparaginezuur, glutaminezuur en de metalloproteïnasen..
Alle metalloproteïnasen hebben een metaalatoom nodig om hun katalytische splitsing uit te voeren. De metalen die aanwezig zijn in metalloproteïnasen omvatten voornamelijk zink, maar andere metalloproteïnasen gebruiken kobalt.
Om zijn functie te kunnen uitoefenen, moet het metaalatoom gecoördineerd gecomplexeerd zijn met het eiwit. Dit gebeurt via vier contactpunten.
Drie van hen gebruiken een van de geladen aminozuren histidine, lysine, arginine, glutamaat of aspartaat. Het vierde coördinatiepunt wordt gemaakt door een watermolecuul.
Classificatie
De International Union of Biochemistry and Molecular Biology heeft een classificatiesysteem voor enzymen opgesteld. In dit systeem worden de enzymen geïdentificeerd door de letters EC en een gecodificeerd systeem van vier cijfers.
Het eerste nummer identificeert enzymen volgens hun werkingsmechanisme en verdeelt ze in zes grote klassen. Het tweede cijfer scheidt ze volgens het substraat waarop ze werken. De andere twee nummers voeren zelfs nog specifiekere divisies uit.
Omdat metalloproteïnasen hydrolysereacties katalyseren, worden ze volgens dit classificatiesysteem geïdentificeerd met het nummer EC4. Bovendien behoren ze tot subklasse 4, waarin alle hydrolasen zijn ondergebracht die op peptidebindingen werken..
Metalloproteïnasen kunnen, net als de rest van de proteïnasen, worden geclassificeerd op basis van de plaats van de polypeptideketen die aanvalt.
-Metalloproteïnasen exopeptidasen
Ze werken op de peptidebindingen van de terminale aminozuren van de polypeptideketen. Alle metalloproteïnasen die twee katalytische metaalionen hebben en sommige met een enkel metaalion, zijn hier opgenomen..
-Metalloproteïnasen endopeptidasen
Ze werken op elke peptidebinding in de polypeptideketen, wat resulteert in twee polypeptidemoleculen met een lager molecuulgewicht..
Veel van de metalloproteïnasen met een enkel katalytisch metaalion werken op deze manier. Dit omvat matrixmetalloproteïnasen en ADAM-eiwitten.
Matrix Metalloproteïnases (MMP)
Het zijn enzymen die katalytisch kunnen werken op sommige componenten van de extracellulaire matrix. De extracellulaire matrix is de verzameling van alle stoffen en materialen die deel uitmaken van een weefsel en die aan de buitenkant van cellen worden aangetroffen.
Ze vormen een grote groep enzymen die aanwezig zijn in fysiologische processen en deelnemen aan morfologische en functionele veranderingen van veel weefsels..
In skeletspieren spelen ze bijvoorbeeld een zeer belangrijke rol bij de vorming, hermodellering en regeneratie van spierweefsel. Ze werken ook op de verschillende soorten collagenen die aanwezig zijn in de extracellulaire matrix.
Collagenasen (MMP-1, MMP-8, MMP-13, MMP-18)
Hydrolytische enzymen die werken op type I, II en III collageen dat tussen cellen wordt aangetroffen. Product van het katabolisme van deze stoffen wordt verkregen gedenatureerd collageen of gelatine.
Bij gewervelde dieren wordt dit enzym geproduceerd door verschillende cellen, zoals fibroblasten en macrofagen, maar ook door epitheelcellen. Ze kunnen ook inwerken op andere moleculen van de extracellulaire matrix.
Gelatinases (MMP-2, MMP-9)
Ze helpen bij het katabolisme van type I, II en III collagenen. Ze werken ook op gedenatureerd collageen of gelatine verkregen na de werking van collagenasen..
Stromalysins (MMP-3, MMP-10, MMP-11)
Ze werken op type IV collagenen en op andere extracellulaire matrixmoleculen die geassocieerd zijn met collageen. Zijn activiteit op gelatine is beperkt.
Matrilisins (MMP-7, MMP-26).
Het zijn structureel eenvoudigere metalloproteïnasen dan de andere. Ze zijn gerelateerd aan tumorepitheelcellen.
Membraan-geassocieerde metalloproteasen (MT-MMP)
Deze maken deel uit van de keldermembranen. Ze nemen deel aan de proteolytische activiteiten van andere matrixmetalloproteïnasen.
Neprilysin
Neprilysin is een matrix metalloproteïnase met zink als katalysatorion. Het is verantwoordelijk voor het hydrolyseren van de peptiden aan het amino-terminale hydrofobe residu.
Dit enzym wordt aangetroffen in tal van organen, waaronder de nieren, hersenen, longen en vasculaire gladde spieren, evenals in endotheel-, hart-, bloed-, vet- en fibroblastcellen..
Neprilysin is essentieel voor de metabolische afbraak van vasoactieve peptiden. Sommige van deze peptiden werken als vaatverwijders, maar andere hebben vaatvernauwende effecten..
Neprisiline-remming, in combinatie met angiotensinereceptor-remming, is een veelbelovende alternatieve therapie geworden voor de behandeling van patiënten met hartfalen.
Andere matrixmetalloproteïnasen
Er zijn enkele metalloproteïnasen die niet in een van de bovenstaande categorieën vallen. Een voorbeeld hiervan hebben we de MMP-12; MMP-9; MMP-20; MMP-22; MMP-23 en MMP-28.
-ADAM-eiwitten
ADAM's (A Disintegrin And Metalloprotease) zijn een groep metalloproteïnases, bekend als metalloproteasen - desintegrines..
Deze omvatten enzymen die delen van eiwitten knippen of verwijderen die door het celmembraan uit de cel worden uitgesloten..
Sommige ADAM's, vooral bij mensen, missen een functioneel proteasedomein. De belangrijkste functies zijn onder meer het beïnvloeden van de spermatogenese en de fusie van sperma en eieren. Ze zijn een belangrijk onderdeel van het gif van veel slangen.
Andere functies en wijzigingen
Eiwitmodificatie
Metalloproteïnases kunnen deelnemen aan de modificatie (rijping) van sommige eiwitten in posttranslationele processen.
Dit kan gebeuren samen met of volgend op de synthese van het doeleiwit of op de uiteindelijke plaats waar het verblijft om zijn functie uit te oefenen. Dit wordt in het algemeen bereikt met de splitsing van een beperkt aantal aminozuurresiduen van het doelmolecuul..
Bij uitgebreidere splitsingsreacties kunnen de doeleiwitten volledig worden afgebroken.
Gezondheidseffecten
Elke wijziging in de werking van metalloproteïnasen kan ongewenste effecten hebben op de menselijke gezondheid. Bovendien brengen sommige andere pathologische processen op de een of andere manier de deelname van deze belangrijke groep enzymen met zich mee.
Matrix metalloproteinase 2 speelt bijvoorbeeld een belangrijke rol bij de invasie, progressie en metastase van kanker, waaronder endometriumkanker. In andere gevallen is verandering van MME-homeostase in verband gebracht met artritis, ontsteking en sommige soorten kanker.
Ten slotte vervullen metalloproteïnasen andere functies in de natuur die niet direct verband houden met de fysiologie van het individu dat ze produceert. Voor sommige dieren is bijvoorbeeld de productie van gifstoffen belangrijk in hun manier van overleven..
In feite bevat het gif van veel slangen een complexe mix van bioactieve stoffen. Onder hen zijn verschillende metalloproteïnasen die onder meer bloedingen, weefselschade, oedeem, necrose en andere effecten bij het slachtoffer veroorzaken..
Bijbehorende pathologieën
Het is mogelijk geweest om vast te stellen dat de enzymen van de MMP-familie deelnemen aan de ontwikkeling van verschillende ziekten; huidziekten, vasculaire disfuncties, cirrose, longemfyseem, cerebrale ischemie, artritis, parodontitis en kankermetastasen.
Aangenomen wordt dat de grote verscheidenheid aan vormen die in matrixmetalloproteïnasen kunnen voorkomen, de verandering van verschillende mechanismen van genetische regulatie kan bevorderen, wat leidt tot een verandering in het genetische profiel..
Om de ontwikkeling van pathologieën geassocieerd met MMP te remmen, zijn verschillende remmers van metallopreïnasen, zowel natuurlijke als kunstmatige, gebruikt..
Natuurlijke remmers zijn geïsoleerd uit talrijke mariene organismen, waaronder vissen, weekdieren, algen en bacteriën. Synthetische remmers bevatten daarentegen over het algemeen een chelerende groep die het katalytische metaalion bindt en inactiveert. De resultaten die met deze therapieën zijn verkregen, waren echter niet overtuigend.
Therapeutische toepassingen
Matrixmetalloproteïnasen hebben verschillende therapeutische toepassingen. Ze worden gebruikt om brandwonden te behandelen, evenals verschillende soorten zweren. Ze zijn ook gebruikt om littekenweefsel te verwijderen en om het regeneratieproces bij orgaantransplantaties te vergemakkelijken..
Referenties
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walters, P. (2014) Moleculaire biologie van de cel, 6th Editie. Garland Science, Taylor & Francis Group. Abingdon-on-Thames, Verenigd Koninkrijk.
- Caley, M. P., Martins, V. L. C., O'Toole, E. A. (2015) Metalloproteïnasen en wondgenezing. Vooruitgang in wondzorg, 4: 225-234.
- Löffek, S., Schilling, O., Franzke, C.-W. (2011) Biologische rol van matrixmetalloproteïnasen: een kritisch evenwicht. European Respiratory Journal, 38: 191-208.
- Opalińska, M., Jańska, H. (2018) AAA-proteasen: bewakers van mitochondriale functie en homeostase. Cellen, 7: 163. doi: 10.3390 / cellen7100163.
- Rima, M., Alavi-Naini, S. M., Karam, M., Sadek, R., Sabatier, J.-M., Fajloun, Z. (2018) Vipers of the Middle East: een rijke bron van bioactieve moleculen. Moleculen.

Niemand heeft nog op dit artikel gereageerd.