
Kenmerkende myofibrillen, structuur, samenstelling, functies

De myofibrillen Het zijn de structurele eenheden van spiercellen, ook wel spiervezels genoemd. Ze zijn zeer talrijk, zijn parallel gerangschikt en zijn ingebed door het cytosol van deze cellen.
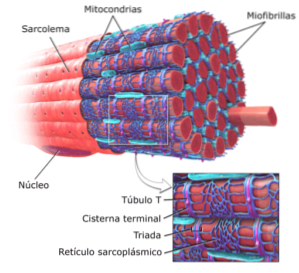
Gegroefde spiercellen of vezels zijn zeer lange cellen, met een lengte tot 15 cm en een diameter van 10 tot 100 μm. Zijn plasmamembraan staat bekend als sarcolemma en zijn cytosol als sarcoplasma..
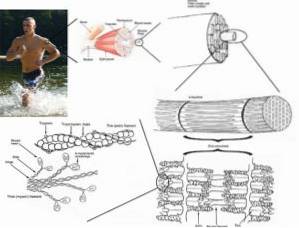
Binnen deze cellen bevinden zich, naast de myofibrillen, meerdere kernen en mitochondriën die bekend staan als sarcosomen, evenals een prominent endoplasmatisch reticulum dat bekend staat als het sarcoplasmatisch reticulum..
Myofibrillen worden erkend als de "contractiele elementen" van spieren bij gewervelde dieren. Ze zijn samengesteld uit verschillende soorten eiwitten die ze de elastische en intrekbare eigenschappen geven. Bovendien bezetten ze een belangrijk deel van het sarcoplasma van de spiervezels.
Artikel index
- 1 Verschillen tussen spiervezels
- 2 Algemene kenmerken
- 2.1 Vorming van myofibrillen of "myofibrillogenese"
- 3 Structuur en samenstelling
- 3.1 - Dunne myofilamenten
- 3.2 - Dikke myofilamenten
- 3.3 - Bijbehorende eiwitten
- 4 functies
- 5 referenties
Verschillen tussen spiervezels
Er zijn twee soorten spiervezels: gestreepte en gladde vezels, elk met een anatomische verdeling en een specifieke functie. Myofibrillen zijn vooral belangrijk en duidelijk in de dwarsgestreepte spiervezels waaruit skeletspieren bestaan..
Gegroefde vezels vertonen een zich herhalend patroon van transversale banden wanneer ze onder een microscoop worden waargenomen en worden geassocieerd met skeletspieren en een deel van de hartspieren..
Gladde vezels vertonen daarentegen niet hetzelfde patroon onder de microscoop en worden aangetroffen in de karakteristieke spieren van het vaatstelsel en het spijsverteringsstelsel (en alle ingewanden).
Algemene karakteristieken
Myofibrillen bestaan uit twee soorten contractiele filamenten (ook bekend als myofilamenten), die op hun beurt weer bestaan uit de filamenteuze eiwitten myosine en actine, die later zullen worden beschreven..
Verschillende onderzoekers hebben vastgesteld dat de halfwaardetijd van de contractiele eiwitten van de myofibrillen varieert van 5 dagen tot 2 weken, zodat de spier een zeer dynamisch weefsel is, niet alleen vanuit contractiel oogpunt, maar ook vanuit de synthese en vernieuwing. standpunt. van zijn structurele elementen.
De functionele eenheid van elke myofibril in spiercellen of vezels wordt een sarcomeer genoemd en wordt begrensd door een gebied dat bekend staat als de 'Z-band of lijn', van waaruit de actine-myofilamenten zich parallel uitstrekken..
Omdat de myofibrillen een aanzienlijk deel van het sarcoplasma innemen, beperken deze vezelachtige structuren de locatie van de kernen van de cellen waartoe ze behoren naar de periferie van de cellen, dichtbij het sarcolemma..
Sommige menselijke pathologieën houden verband met de verplaatsing van de kernen naar de myofibrillaire bundels, en deze staan bekend als centro-nucleaire myopathieën..
Vorming van myofibrillen of "myofibrillogenese"
De eerste myofibrillen worden geassembleerd tijdens de ontwikkeling van embryonale skeletspieren.
De eiwitten waaruit sarcomeren (de functionele eenheden van myofibrillen) bestaan, zijn aanvankelijk uitgelijnd vanaf de uiteinden en zijkanten van 'premiofibrillen' die zijn samengesteld uit actinefilamenten en kleine porties niet-musculaire myosine II en specifiek α-actine van spierweefsel..
Als dit gebeurt, worden de genen die coderen voor de cardiale en skeletale isovormen van α-actine uitgedrukt in verschillende verhoudingen in spiervezels. Eerst is de hoeveelheid cardiale isovorm die wordt uitgedrukt groter en dan verandert dit in de richting van het skelet.
Na de vorming van de premiofibrillen, verzamelen de myofibrillen in wording zich achter de zone van premiofibrilvorming en in deze wordt de spiermyosine II-vorm gedetecteerd..
Op dit punt worden de myosinefilamenten uitgelijnd en complex met andere specifieke myosine-bindende eiwitten, wat ook voorkomt bij actinefilamenten..
Structuur en samenstelling
Zoals zojuist besproken, zijn myofibrillen samengesteld uit contractiele eiwit-myofilamenten: actine en myosine, die ook bekend staan als respectievelijk dunne en dikke myofilamenten. Deze zijn zichtbaar onder de lichtmicroscoop.
- Dunne myofilamenten
De dunne filamenten van de myofibrillen bestaan uit het eiwit actine in zijn filamenteuze vorm (actine F), een polymeer met de bolvorm (actine G), dat een kleinere afmeting heeft.
De filamenteuze strengen van G-actine (F-actine) vormen een dubbele streng die tot een helix oprolt. Elk van deze monomeren weegt ongeveer 40 kDa en is in staat myosine op bepaalde plaatsen te binden..
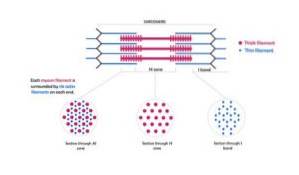
Deze filamenten hebben een diameter van ongeveer 7 nm en strekken zich uit tussen twee gebieden die bekend staan als band I en band A. In band A bevinden deze filamenten zich rond de dikke filamenten en vormen ze een secundaire hexagonale rangschikking..
Concreet is elk dun filament symmetrisch gescheiden van drie dikke filamenten, en elk dik filament is omgeven door zes dunne filamenten.
Dunne en dikke filamenten staan met elkaar in wisselwerking via "kruisbruggen" die uit de dikke filamenten steken en verschijnen in de myofibrilstructuur met regelmatige intervallen van afstanden dichtbij 14 nm..
De actinefilamenten en andere geassocieerde eiwitten strekken zich uit voorbij de "randen" van de Z-lijnen en overlappen de myosinefilamenten naar het midden van elk sarcomeer..
- Dikke myofilamenten
De dikke filamenten zijn polymeren van het myosine II-eiwit (elk 510 kDa) en worden begrensd door gebieden die bekend staan als "A-banden".
Myosine-myofilamenten zijn ongeveer 16 nm lang en zijn gerangschikt in hexagonale rangschikkingen (als een doorsnede van een myofibril wordt waargenomen).
Elk myosine II-filament bestaat uit vele gepakte myosinemoleculen, elk bestaande uit twee polypeptideketens die een knotsvormig gebied of "kop" hebben en die zijn gerangschikt in "bundels" om de filamenten te vormen..
Beide bundels worden over hun uiteinden in het midden van elk sarcomeer gehouden, zodat de "koppen" van elk myosine naar de Z-lijn zijn gericht, waar de dunne filamenten zijn bevestigd..
De myosinekoppen vervullen zeer belangrijke functies, omdat ze bindingsplaatsen hebben voor ATP-moleculen en bovendien, tijdens spiercontractie, kruisbruggen kunnen vormen om te interageren met de dunne actinefilamenten..
- Bijbehorende eiwitten
Actinefilamenten zijn "verankerd" of "gefixeerd" aan het plasmamembraan van spiervezels (sarcolemma) dankzij hun interactie met een ander eiwit dat bekend staat als dystrofine..
Daarnaast zijn er twee belangrijke actine-bindende eiwitten, bekend als troponine en tropomyosine, die samen met actinefilamenten een eiwitcomplex vormen. Beide eiwitten zijn essentieel voor de regulering van de interacties die plaatsvinden tussen dunne en dikke filamenten..
Tropomyosine is ook een tweestrengs filamenteus molecuul dat specifiek in het gebied van de groeven tussen de twee strengen associeert met actine-helices. Troponine is een tripartiet globulair eiwitcomplex dat in intervallen op de actinefilamenten is gerangschikt.
Dit laatste complex functioneert als een calciumafhankelijke "schakelaar" die de contractieprocessen van spiervezels regelt, en daarom is het van het grootste belang..
In de dwarsgestreepte spier van gewervelde dieren zijn er bovendien twee andere eiwitten die een interactie aangaan met de dikke en dunne filamenten, bekend als respectievelijk titine en nebuline..
Nebulin heeft belangrijke functies bij het reguleren van de lengte van actinefilamenten, terwijl titine deelneemt aan de ondersteuning en verankering van myosinefilamenten in een gebied van het sarcomeer dat bekend staat als de M-lijn..
Andere eiwitten
Er zijn andere eiwitten die worden geassocieerd met de dikke myofilamenten die bekend staan als myosine-bindend proteïne C en myomesine, die verantwoordelijk zijn voor de fixatie van myosinefilamenten in de M-lijn..
Kenmerken
Myofibrillen hebben elementaire implicaties voor het bewegingsvermogen van gewervelde dieren.
Omdat ze worden gevormd door de fibreuze en contractiele eiwitcomplexen van het spierapparaat, zijn deze essentieel voor het uitvoeren van de reacties op de zenuwprikkels die leiden tot beweging en verplaatsing (in dwarsgestreepte skeletspieren).
De onbetwistbare dynamische eigenschappen van skeletspieren, die meer dan 40% van het lichaamsgewicht uitmaken, worden verleend door de myofibrillen die tegelijkertijd tussen 50 en 70% van de eiwitten in het menselijk lichaam bezitten.
De myofibrillen, als onderdeel van deze spieren, nemen deel aan al zijn functies:
- Mechanisch: om chemische energie om te zetten in mechanische energie om kracht op te wekken, houding te behouden, bewegingen te produceren, enz..
- Metabool: aangezien de spier deelneemt aan het basale energiemetabolisme en dient als opslagplaats voor fundamentele stoffen zoals aminozuren en koolhydraten; Het draagt ook bij aan de productie van warmte en het verbruik van energie en zuurstof die worden gebruikt tijdens fysieke activiteiten of sportoefeningen.
Omdat myofibrillen voornamelijk uit eiwitten bestaan, vertegenwoordigen ze een opslag- en afgifteplaats voor aminozuren die bijdragen aan het behoud van bloedglucosespiegels tijdens vasten of uithongering..
Ook is het vrijkomen van aminozuren uit deze spierstructuren belangrijk vanuit het oogpunt van de biosynthetische behoeften van andere weefsels zoals de huid, hersenen, hart en andere organen..
Referenties
- Despopoulos, A., & Silbernagl, S. (2003). Kleurenatlas van de fysiologie (5e ed.). New York: Thieme.
- Friedman, A. L., & Goldman, Y. E. (1996). Mechanische karakterisering van myofibrillen van skeletspieren. Biophysical Journal, 71(5), 2774-2785.
- Frontera, W. R., en Ochala, J. (2014). Skeletspier: een kort overzicht van structuur en functie. Calcif Tissue Int, Vier vijf(2), 183-195.
- Goldspink, G. (1970). De proliferatie van myofibrillen tijdens de groei van spiervezels. J. Cell Sct., 6, 593-603.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harper's geïllustreerde biochemie (28e ed.). McGraw-Hill Medical.
- Rosen, J. N., en Baylies, M. K. (2017). Myofibrils zetten de druk op kernen. Nature Cell Biology, 19(10).
- Sanger, J., Wangs, J., Fan, Y., White, J., Mi-Mi, L., Dube, D.,… Pruyne, D. (2016). Montage en onderhoud van myofibrillen in de gestreepte spier. In Handbook of Experimental Pharmacology (p.37). New York, VS: Springer International Publishing Switzerland.
- Sanger, J. W., Wang, J., Fan, Y., White, J., & Sanger, J. M. (2010). Montage en dynamiek van myofibrillen. Journal of Biomedicine and Biotechnology, 2010, 8.
- Sobieszek, A., & Bremel, R. (1975). Bereiding en eigenschappen van gewervelde gladde spiermyofibrillen en actomyosine. European Journal of Biochemistry, 55(1), 49-60.
- Villee, C., Walker, W., & Smith, F. (1963). Algemene zoölogie (2e ed.). Londen: W. B. Saunders Company.



Niemand heeft nog op dit artikel gereageerd.