
Calciumnitraat (Ca (NO3) 2) structuur, eigenschappen en toepassingen

De calciumnitraat is een tertiair anorganisch zout waarvan de chemische formule Ca (NO3twee. Uit zijn formule is bekend dat zijn vaste stof is samengesteld uit Ca-ionentwee+ en nee3- in een verhouding van 1: 2. Daarom is het een verbinding van puur ionische aard..
Een van de eigenschappen is het oxiderende karakter door het nitraatanion. Het is niet brandbaar, dat wil zeggen, het brandt niet bij hoge temperaturen. Omdat het onbrandbaar is, is het een veilige vaste stof die zonder veel zorg kan worden gehanteerd; het kan echter de ontbranding van brandbare materialen versnellen.

Het uiterlijk bestaat uit een korrelige vaste stof, die een witte of lichtgrijze kleur heeft (bovenste afbeelding). Het kan watervrij of tetrahydraat zijn, Ca (NO3twee4HtweeO. Het is zeer oplosbaar in water, methanol en aceton.
Calciumnitraat wordt veel gebruikt als meststof, omdat het gemakkelijk in vochtige grond reist en snel wordt opgenomen door plantenwortels. Biedt twee belangrijke elementen voor plantenvoeding en groei: stikstof en calcium.
Stikstof is een van de drie essentiële elementen voor de ontwikkeling van planten (N, P en K), het is essentieel bij de synthese van eiwitten. Ondertussen is calcium nodig om de structuur van de plantencelwand te behouden. Om deze reden Ca (NO3twee veel gaat naar tuinen.
Aan de andere kant heeft dit zout een giftige werking, vooral door direct contact met de huid en ogen, en ook door het inademen van stof. Bovendien kan het worden afgebroken door verwarming.
Artikel index
- 1 Structuur van calciumnitraat
- 2 Fysische en chemische eigenschappen
- 2.1 Chemische namen
- 2.2 Moleculaire formule
- 2.3 Molecuulgewicht
- 2.4 Fysiek voorkomen
- 2.5 Kookpunt
- 2.6 Smeltpunt
- 2.7 Oplosbaarheid in water
- 2.8 Oplosbaarheid in organische oplosmiddelen
- 2.9 Zuurgraad (pKa)
- 2.10 Dichtheid
- 2.11 Ontleding
- 2.12 Reactief profiel
- 3 toepassingen
- 3.1 Landbouw
- 3.2 Beton
- 3.3 Riolering of afvalwaterbehandeling
- 3.4 Koude kompressen maken
- 3.5 Latexcoagulatie
- 3.6 Warmteoverdracht en opslag
- 4 Aanvraagformulieren
- 5 referenties
Structuur van calciumnitraat
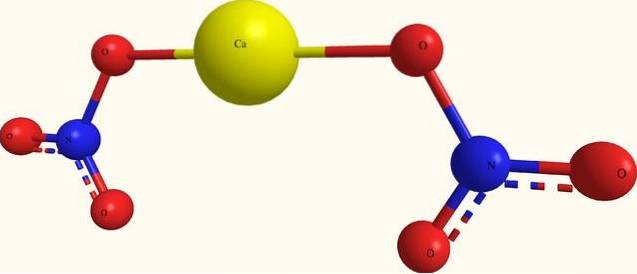
De bovenste afbeelding toont de structuur van Ca (NO3twee in een model van bollen en balken. Hier is er echter een fout: het bestaan van covalente Ca-O-bindingen wordt verondersteld, wat hun ionische karakter tegenspreekt. Om dit te verduidelijken, zijn de interacties in feite van het elektrostatische type.
Het kation Catwee+ omringt zichzelf met twee GEEN anionen3- volgens zijn verhoudingen op het glas. Daarom overheerst stikstof in de vorm van nitraat in de kristallijne structuur..
De ionen zijn zo gegroepeerd dat ze een configuratie tot stand brengen waarvan de minimale expressie de eenheidscel is; wat, voor het watervrije zout, kubisch is. Dat wil zeggen, van kubussen die de 1: 2-verhouding voor deze ionen bevatten, wordt het hele kristal gereproduceerd.
Aan de andere kant, het tetrahydraatzout, Ca (NO3twee4HtweeOf het heeft vier watermoleculen voor elke set NO3- ACtwee+ NIET3-. Dit wijzigt de kristalstructuur en vervormt het tot een monokliene eenheidscel..
Daarom wordt verwacht dat de kristallen voor zowel de watervrije als de tetrahydraatzouten verschillend zijn; verschillen die kunnen worden bepaald in hun fysische eigenschappen, bijvoorbeeld smeltpunten.
Fysische en chemische eigenschappen
Chemische namen
-Calciumnitraat
-Calciumdinitraat
-Nitrocalciet
-Noorse salpeter en limesaltpetro.
Moleculaire formule
Tuit3twee of CaNtweeOF6
Molecuulgewicht
Watervrij 164,088 g / mol en tetrahydraat 236,15 g / mol. Let op het effect van water op het molecuulgewicht, en het kan niet worden verwaarloosd bij het wegen..
Fysiek uiterlijk
Witte of lichtgrijze vaste stof of korrels. Kubieke witte kristallen of vervloeiende korrels; dat wil zeggen, ze absorberen vocht tot het punt dat ze oplossen als gevolg van hun hoge oplosbaarheid.
Kookpunt
De watervrije vorm ontleedt bij verhitting tot een temperatuur die de bepaling van het kookpunt verhindert; terwijl de tetrahydraatvorm van het zout een kookpunt heeft van 132 ° C (270 ° F, 405 K).
Smeltpunt
-Watervrije vorm: 561 ° C tot 760 mmHg (1042 ° F, 834 K).
-Tetrahydraatvorm: 42,7 ° C (109 ° F, 316 K).
Dit laat zien hoe watermoleculen interfereren met elektrostatische interacties tussen Catwee+ en nee3- in de kristallen; en dientengevolge smelt de vaste stof bij een veel lagere temperatuur.
Oplosbaarheid in water
-Watervrije vorm: 1212 g / l bij 20 ºC.
-Tetrahydraatvorm: 1290 g / l bij 20 ºC.
Het water in de kristallen verhoogt de oplosbaarheid van het zout nauwelijks.
Oplosbaarheid in organische oplosmiddelen
-In ethanol, 51,42 g / 100 g bij 20 ° C.
-In methanol, 134 g / 100 g bij 10 ° C.
-In aceton, 168 g / 100 g bij 20 ° C.
Zuurgraad (pKa)
6.0
Dichtheid
2,5 g / cm3 bij 25 ºC (tetrahydraat).
Ontleding
Wanneer calciumnitraat tot gloeien wordt verhit, valt het uiteen in calciumoxide, stikstofoxide en zuurstof..
Reactief profiel
Het is een sterk oxidatiemiddel, maar het is niet brandbaar. Versnelt de ontbranding van brandbare materialen. De verdeling van calciumnitraat in fijne deeltjes, vergemakkelijkt de explosie wanneer de verbinding wordt blootgesteld aan langdurig vuur.
Mengsels met alkylesters worden explosief door het ontstaan van alkylnitraatesters. De combinatie van calciumnitraat met fosfor, tin (II) chloride of een ander reductiemiddel kan explosief reageren.
Toepassingen
landbouw
Het wordt in gewassen gebruikt als een bron van stikstof en calcium. Calciumnitraat is zeer oplosbaar in water en wordt gemakkelijk opgenomen door plantenwortels. Bovendien verzuurt het de bodems niet omdat zijn ionen niet significant kunnen worden gehydrolyseerd..
Het mengen met meststoffen die fosfor of sulfaat bevatten, moet worden vermeden om de vorming van onoplosbare zouten te voorkomen. Vanwege zijn hygroscopiciteit moet het in een droge en koele omgeving worden bewaard.
Het gebruik ervan heeft een voordeel ten opzichte van het gebruik van ammoniumnitraat als meststof. Hoewel deze laatste verbinding stikstof aan planten bijdraagt, verstoort het de calciumopname, wat kan leiden tot een calciumtekort bij planten..
Calcium draagt bij aan het behoud van de celwandstructuur van planten. Bij een calciumtekort vertonen de groeiende weefsels van planten, zoals wortelpunten, jonge bladeren en scheutuiteinden, vaak een vertekende groei..
Verminderde ammoniak
Calciumnitraat vermindert de ophoping van vluchtige vetzuren en fenolische verbindingen, fytotoxisch die zich ophopen door de afbraak van gewasresten van sojabonen.
Daarnaast is er een tendens dat calciumnitraat de ammoniumconcentratie in de bodem verlaagt, waardoor de waterstofbuffercapaciteit toeneemt..
Beton
Calciumnitraat wordt gebruikt om de hardingstijd van beton te verkorten. Dit wordt geproduceerd door de vorming van calciumhydroxide, misschien door een dubbele verplaatsingsreactie..
Bovendien induceert calciumnitraat de vorming van de ijzerhydroxideverbinding, waarvan de beschermende werking op beton de corrosie vermindert. Dat wil zeggen, het aanwezige ijzer kan reageren met de basiscomponenten van beton, zoals calciumhydroxide zelf..
Calciumnitraat vermindert de uithardingstijd, evenals de weerstand van het beton waaraan vulkanische as is toegevoegd. Om het effect van het toevoegen van calciumnitraat aan beton te bestuderen, zijn oplopende concentraties calciumnitraat gebruikt, tussen 2% en 10%..
Er is een grotere afname van de uithardingstijd waargenomen, evenals een toename van de betonsterkte naarmate de calciumnitraatconcentratie tot 10% toenam.
Riolering of afvalwaterbehandeling
Calciumnitraat wordt gebruikt om geuren uit rioolwater te verminderen door de vorming van waterstofsulfide te verminderen. Bovendien wordt de organische stof die anaërobe omstandigheden genereert, geconsumeerd, waardoor het voor veel biologische soorten moeilijk is om te overleven..
Koude kompressen maken
Calciumnitraat-tetrahydraat is een endotherme verbinding, dat wil zeggen dat het de mogelijkheid heeft om warmte uit de omgeving te absorberen. Dit zorgt voor een koeling van de lichamen die in contact komen met de containers die het bevatten..
De kompressen verhogen hun temperatuur en om ze te regenereren is het voldoende om ze in een vriezer te plaatsen
Latex coagulatie
Calciumnitraat wordt gebruikt in de latexcoagulatiefase. Het maakt deel uit van de immersie-oplossing, en wanneer het in contact komt met de oplossing die de latex bevat, breekt het zijn stabilisatie en veroorzaakt het zijn coagulatie..
Warmteoverdracht en opslag
Het binaire mengsel van gesmolten nitraatzouten, waaronder calcium met andere nitraten, wordt gebruikt in plaats van thermische olie in zonne-energiecentrales voor warmteoverdracht en opslag.
Formulieren van aanvraag
-Calciumnitraat wordt gemengd met de grond aangebracht in een concentratie van 1,59 kg per 30,48 mtwee, met voldoende water geven. Calciumnitraat wordt opgelost in water, waardoor het door de wortels van de plant kan worden opgenomen. In hydrocultuurgewassen lost het op in groeiend water.
-Calciumnitraat wordt ook gebruikt in de vorm van een spray om de bladeren en bloemen te besproeien, als een effectieve behandeling om het rotten van de tomatenbloem, de kurkvlek en de bittere pit van de appel te voorkomen..
-Aan het betonvormende mengsel (cement, zand, stenen en water) wordt een hoeveelheid calciumnitraat toegevoegd en het effect dat de toevoeging heeft op de specifieke eigenschappen van het beton wordt bepaald; zoals het instellen van snelheid en kracht.
-Calciumnitraat wordt in een geschikte concentratie toegevoegd om geuren uit riool- of afvalwater te verminderen tot een niveau dat geuren aanvaardbaar zijn voor mensen.
Referenties
- Bonnie L. Grant. (2019). Calciumnitraatmeststof - Wat doet calciumnitraat voor planten. Hersteld van: gardenknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. en Vyn, T.J. (1990). Het gebruik van calciumnitraat om de ophoping van fytotoxine tijdens de afbraak van lichaamsresten te verminderen. Canadian Journal of Soil Science 70 (4): 723-726.
- Ogunbode, E. B. en Hassan, I.O. (2011). Effect van toevoeging van calciumnitraat op selectieve eigenschappen van beton dat vulkanische as bevat. Leonardo Electronic Journal of Practices Technologies 19: 29-38.
- Wikipedia. (2019). Calciumnitraat. Hersteld van: en.wikipedia.org
- Shiqi Dong & col. (2018). Remming van staalcorrosie door calciumnitraat in met halogenide verrijkte afwerkingsvloeistoffen. npj Materials Degradation volume 2, Artikelnummer: 32.
- Emaginationz Technologies. (2019). Calciumnitraat specificaties. Hersteld van: direct2farmer.com
- PubChem. (2019). Calciumnitraat. Hersteld van: pubchem.ncbi.nlm.nih.gov



Niemand heeft nog op dit artikel gereageerd.