
Natriumnitraat (NaNO3) structuur, eigenschappen, gebruik, risico's

De natriumnitraat is een kristallijne anorganische vaste stof gevormd door een natriumion Na+ en een nitraation NO3-. De chemische formule is NaNO3. In de natuur komt het voor als het mineraal nitratine of nitratiet, dat in overvloed voorkomt in de Atacama woestijn in Chili, daarom wordt dit mineraal ook wel Chileense salpeter of caliche genoemd..
Natriumnitraat is een niet-brandbare vaste stof, maar het kan de oxidatie of verbranding van brandbare materialen versnellen. Om deze reden wordt het veel gebruikt in vuurwerk, explosieven, lucifers, steenkoolstenen en sommige soorten pesticiden om knaagdieren en andere kleine zoogdieren te doden..

Het vermogen om verbranding of ontbranding van andere materialen te bevorderen, betekent dat er met grote voorzichtigheid mee moet worden omgegaan. Bij blootstelling aan vlammen of vuur kan het ontploffen. Desondanks heeft de NaNO3 Het wordt gebruikt in de voedingsindustrie omdat het conserverende eigenschappen heeft, vooral voor vleeswaren en sommige kaassoorten..
Teveel inslikken kan echter gezondheidsproblemen veroorzaken, vooral bij zwangere vrouwen, baby's en kinderen. Door om te zetten in nitrieten in het spijsverteringsstelsel, kan het bepaalde ziekten veroorzaken.
Artikel index
- 1 Chemische structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3,7 pH
- 3.8 Overige eigenschappen
- 4 Verkrijgen
- 4.1 Aanwezigheid in het menselijk lichaam
- 5 toepassingen
- 5.1 In de voedingsindustrie
- 5.2 In meststoffen
- 5.3 Als promotor of facilitator van verbranding of explosie
- 5.4 Uitroeiing van knaagdieren en andere zoogdieren
- 5.5 Bij de bereiding van andere verbindingen
- 5.6 Bij de winning van metalen uit elektronisch afval
- 5.7 Bij gezondheids- en bewegingsonderzoek
- 5.8 In verschillende toepassingen
- 6 Risico's
- 6.1 Gevaren bij het hanteren
- 6.2 Problemen die verband houden met de inname ervan met voedsel of water
- 7 Natriumnitraat in voedsel
- 8 referenties
Chemische structuur
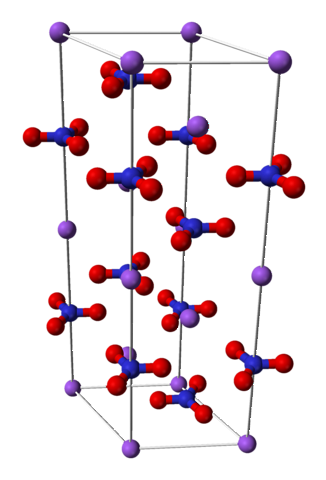
Natriumnitraat bestaat uit een natriumkation Na+ en een nitraatanion NO3-.
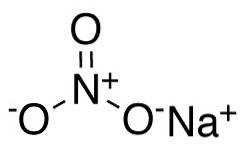
In het nitraatanion NO3- stikstof N heeft een valentie van +5 en zuurstof een valentie van -2. Om deze reden heeft het nitraatanion een negatieve lading..
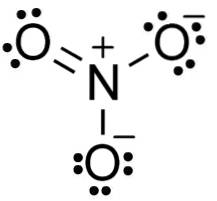
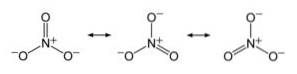
Anion GEEN3- het heeft een vlakke en symmetrische structuur, waarin de drie zuurstofatomen de negatieve lading gelijkmatig of gelijkmatig verdelen.
Nomenclatuur
-Natriumnitraat
-Natriumnitraat
-Natriumsalpeter (uit het Engels natrium salpeter
-Nitro soda (uit het Engels soda salpeter
-Salpeter van Chili
-Nitraat uit Chili
-Nitratin
-Nitratiet
-Caliche
Eigendommen

Fysieke toestand
Kleurloze tot witte vaste, trigonale of rhombohedrale kristallen.
Molecuulgewicht
84,995 g / mol
Smeltpunt
308 ºC
Kookpunt
380 ºC (ontleedt).
Dichtheid
2.257 g / cm3 bij 20 ºC.
Oplosbaarheid
Oplosbaar in water: 91,2 g / 100 g water van 25 ºC of 1 g in 1,1 ml water. Enigszins oplosbaar in ethanol en methanol.
pH
Natriumnitraatoplossingen zijn neutraal, dat wil zeggen, noch zuur noch basisch, daarom is hun pH 7.
Andere eigenschappen
Het is een hygroscopische vaste stof, dat wil zeggen dat het water uit de omgeving opneemt.

Het oplossen in water zorgt ervoor dat de oplossing afkoelt, dus er wordt gezegd dat dit oplossingsproces endotherm is, met andere woorden, wanneer het oplost, absorbeert het warmte uit de omgeving en daarom koelt de oplossing af..
Bij zeer lage temperaturen is natriumnitraat oplosbaar in vloeibare NH-ammoniak3, het vormen van NaNO34NH3 onder -42 ºC.
Nano3 Het is niet brandbaar, maar zijn aanwezigheid versnelt de verbranding van materialen of verbindingen die dat wel zijn. Dit komt omdat het bij verhitting zuurstof O produceerttwee, onder andere gassen.
Het verkrijgen van
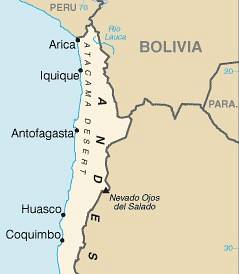
Het wordt voornamelijk verkregen door extractie uit minerale afzettingen of salpeter-mijnen in Chili (caliche of nitratiet). Hiervoor wordt pekel gebruikt en vervolgens wordt kristallisatie en herkristallisatie uitgevoerd om NaNO-kristallen te verkrijgen.3 meer puur.
Deze mijnen komen voornamelijk voor in Zuid-Amerika in het noorden van Chili in de Atacama-woestijn. Daar wordt het geassocieerd met kaliumnitraat KNO3 en ontbindend organisch materiaal.
Het kan ook worden verkregen door salpeterzuur te laten reageren met natriumcarbonaat NatweeCO3 of met natriumhydroxide NaOH:
2 HNO3 + NatweeCO3 → 2 NaNO3 + COtwee↑ + HtweeOF
Aanwezigheid in het menselijk organisme
Natriumnitraat kan het menselijk lichaam binnendringen via voedsel en drinkwater dat het bevat..
60-80% van het ingenomen nitraat is afkomstig van fruit en groenten. Een tweede bron is vleeswaren. Het wordt door de vleesindustrie gebruikt om de groei van microben tegen te gaan en kleur vast te houden.
Een groot deel van het nitraat dat in het menselijk lichaam aanwezig is, is echter afkomstig van de endogene synthese of van processen in het lichaam..
Toepassingen
In de voedingsindustrie
Het wordt gebruikt als conserveermiddel in voedingsmiddelen, als verharder voor gebeitst vlees en als kleurbehoudmiddel voor vlees. Voedingsmiddelen die het kunnen bevatten zijn spek, worstjes, ham en sommige kazen.

In meststoffen
Natriumnitraat wordt gebruikt in meststofmengsels, om tabak, katoen en groentegewassen te bemesten.

Als promotor of promotor van verbranding of explosie
Nano3 het wordt in veel toepassingen als oxidatiemiddel gebruikt. Het is een zuurstofrijke vaste stof die het ontstekingsproces vergemakkelijkt door O te producerentwee.
De aanwezigheid van NaNO3 maakt dat materialen geen zuurstof uit externe bronnen nodig hebben om te ontbranden, aangezien het voldoende O leverttwee om zichzelf in stand te houden exotherme (warmteopwekkende) reacties die optreden tijdens ontsteking of explosie.
Het wordt al lang gebruikt als het belangrijkste oxidatiemiddel in pyrotechnische materialen (vuurwerk), als oxiderende component in explosieven en detonatie- of explosiemiddelen, en als drijfgas.

Het wordt ook gebruikt om de verbranding van houtskoolstenen (briketten) te verbeteren, om de verlichting in lucifers te bevorderen en zelfs om de brandbare eigenschappen van tabak te verbeteren..
Om knaagdieren en andere zoogdieren te elimineren
Het wordt gebruikt voor een speciaal type pesticide. De samenstellingen die het bevatten zijn pyrotechnische ontsmettingsmiddelen die in holen worden geplaatst en in brand worden gestoken, waarbij dodelijke doses giftige gassen vrijkomen.
Om deze reden wordt het gebruikt voor de bestrijding van verschillende knaagdieren, marmotten, coyotes en stinkdieren, in open velden, graslanden, onbebouwde gebieden, gazons en golfbanen..
Bij de bereiding van andere verbindingen
Gebruikt bij de vervaardiging van salpeterzuur HNO3, natriumnitriet NaNOtwee, en werkt ook als katalysator bij de bereiding van zwavelzuur HtweeSW4.
Het wordt gebruikt bij de vervaardiging van lachgas N.tweeOf en als oxidatiemiddel bij de vervaardiging van farmaceutische verbindingen.
Bij de winning van metalen uit e-waste
Bepaalde onderzoekers ontdekten dat NaNO3 vergemakkelijkt de niet-vervuilende winning van metalen in afval van elektronische apparatuur (mobiele telefoons, tablets, computers, enz.).
Bruikbare metalen die kunnen worden gewonnen uit de componenten van deze elektronische apparatuur zijn nikkel-nikkel, kobaltco, mangaan-Mn, zink-zn, koper-Cu en aluminium-Al..
De extractie wordt uitgevoerd met alleen een NaNO-oplossing3 en een polymeer. En er wordt een rendement van 60% behaald.
Op deze manier kan elektronisch afval worden gerecycled, wat bijdraagt aan het minimaliseren van afval en het stabiel terugwinnen van hulpbronnen..
In gezondheids- en bewegingsonderzoek
Volgens sommige onderzoeken de inname van NaNO-supplementen3 of voedingsmiddelen die het van nature bevatten, hebben van nature positieve effecten op de gezondheid. Enkele van de voedingsmiddelen die rijk zijn aan nitraten zijn bieten, spinazie en rucola.
Effecten zijn onder meer het verbeteren van het cardiovasculaire systeem, het verlagen van de bloeddruk, het verbeteren van de bloedstroom en het verhogen van de hoeveelheid zuurstof in weefsels die fysiek aan het trainen zijn..
Dit geeft aan dat het gebruik van NaNO kan worden overwogen.3 als een goedkope medicatie bij de preventie en behandeling van patiënten met bloeddrukproblemen.
Bovendien kan het dienen als een effectief en natuurlijk hulpmiddel om de spierkracht bij atleten te vergroten.
In verschillende toepassingen

Het wordt gebruikt als oxidatiemiddel en vloeimiddel bij de vervaardiging van glazuren van glas en keramiek. Het wordt ook gebruikt in speciale cementen.
Dient als chemisch middel bij het terugwinnen van tin uit metaalschroot, bij latexcoagulatie, in de nucleaire industrie en bij de beheersing van corrosie in waterige systemen.
Risico's
Gevaren bij het hanteren
Het heeft de eigenschap de verbranding van brandbare materialen te versnellen. Als u bij brand betrokken bent, kan er een explosie optreden.
Bij langdurige blootstelling aan hitte of vuur kan het exploderen, waarbij giftige stikstofoxiden vrijkomen..
Problemen die verband houden met het inslikken met voedsel of water
Nitraat kan bij inname nitriet worden, zowel in de mond als in de maag en darmen..
Nitriet kan, wanneer het reageert met de aminen die in sommige voedingsmiddelen aanwezig zijn, nitrosaminen worden in een zure omgeving, zoals in de maag. Nitrosaminen zijn kankerverwekkend.
Dit gebeurt echter niet wanneer fruit en groenten die nitraten bevatten op natuurlijke wijze worden gegeten..
Volgens sommige onderzoeken kan de aanwezigheid van hoge nitraatgehaltes een bloedaandoening veroorzaken waardoor zuurstof niet effectief in de weefsels kan worden afgegeven..
Dit kan voorkomen bij baby's van wie de melkformule is gemaakt van bronwater dat nitraten bevat..
Er is ook waargenomen dat hoge nitraatgehaltes problemen kunnen veroorzaken bij de dracht van baby's, waardoor spontane abortussen, vroeggeboorten of defecten in de neurale buis van de foetus kunnen ontstaan..
Onlangs is ontdekt dat natriumnitraat een risico kan vormen voor de ontwikkeling van het bewegingsapparaat en dat de communicatie tussen zenuw en spier bij mensen wordt beïnvloed..
Natriumnitraat in voedsel

Natriumnitraat is synoniem met vlees, omdat het samen met nitriet eraan wordt toegevoegd om het te behouden en het uiterlijk en de smaak te verbeteren. Vanwege de oorzaak is de overmatige consumptie van vlees (hotdogs, spek, ham, gerookte vis, enz.) Betrokken geweest bij de verontrustende link van kankers door het hele spijsverteringsstelsel..
Hoewel de relatie tussen vlees dat is behandeld met nitraat-nitrietzouten en kanker niet absoluut is, wordt het aanbevolen om uw inname te matigen..
Aan de andere kant zijn groenten (wortelen, bieten, radijs, sla, spinazie, etc.) rijk aan NaNO3 omdat ze het door de bemestende werking van de gewassen hebben opgenomen. De inname van deze groenten, in tegenstelling tot vleesproducten, is niet gekoppeld aan bovengenoemde ziekten.
Dit heeft twee redenen: het verschil in eiwitniveaus van dergelijke voedingsmiddelen en de manier waarop ze worden gekookt. Wanneer vlees wordt gebakken of verhit tot de vlam, wordt de reactie tussen nitraat-nitrieten met bepaalde groepen aminozuren bevorderd, om zo nitrosoamines te produceren: de echte kankerverwekkende stoffen.
Het gehalte aan vitamine C, vezels en polyfenolen in groenten vermindert de vorming van deze nitrosoamines. Dat is de reden waarom NaNO3 alleen vormt geen bedreiging voor voedsel.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Natriumnitraat. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Vijfde editie. VCH Verlagsgesellschaft mbH.
- Pouretedal, H.R. en Ravanbod, M. (2015). Kinetische studie van Mg / NaNO3 pyrotechnisch gebruikmakend van niet-isotherme TG / DSC-techniek. J Therm Anal Calorim (2015) 119: 2281-2288. Opgehaald van link.springer.com.
- Jarosz, J. et al .; (2016). Natriumnitraat vermindert door agrine geïnduceerde acetylcholinereceptorclustering. BMC-farmacologie en toxicologie (2016) 17:20. Opgehaald van bmcpharmacoltoxicol.biomedcentral.com.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Prival, M.J. (2003). Kanker. Kankerverwekkende stoffen in de voedselketen. In Encyclopedia of Food Sciences and Nutrition (Second Edition). Opgehaald van sciencedirect.com.
- Zakhodyaeva, Y.A. et al. (2019). Complexe extractie van metalen in een waterig tweefasensysteem op basis van poly (ethyleenoxide) 1500 en natriumnitraat. Molecules 2019, 24, 4078. Hersteld van mdpi.com.
- Clements, W.T. et al. (2014). Nitraatopname: een overzicht van de gezondheidseffecten en fysieke prestatie-effecten. Voedingsstoffen 2014, 6, 5224-5264. Opgehaald van mdpi.com.



Niemand heeft nog op dit artikel gereageerd.