
Pentanon chemische structuur, eigenschappen, synthese, gebruik
De pentanon is een organische verbinding, behorend tot de ketonenfamilie, waarvan de chemische formule C is5H.10O. Het is nog steeds een van de eenvoudigste ketonen en bestaat uit een kleurloze vloeistof met een aroma dat lijkt op aceton. Vanaf dit punt vertonen ketonen, met betrekking tot het koolstofgetal van hun skelet, positie-isomerie.
Wanneer we het hebben over positie-isomerie, verwijst het naar waar de carbonylgroep is, C = O. Pentanon bestaat dus eigenlijk uit twee verbindingen met fysische eigenschappen die enigszins van elkaar verschillen: 2-pentanon en 3-pentanon (onderste afbeelding). Beide zijn vloeibaar, maar hun kookpunten zijn hetzelfde, dus ze kunnen niet worden gescheiden door destillatie..
Elk van de twee pentanonen heeft echter zijn eigen synthetische route, dus het is onwaarschijnlijk dat er een combinatie van is; mengsel dat mogelijk kan worden gescheiden door bevriezing.
Hun toepassingen zijn in het bijzonder beperkt als organische oplosmiddelen; alternatieven voor aceton in omgevingen waar het wordt gebruikt bij een temperatuur hoger dan het lage kookpunt. Evenzo zijn ze uitgangsmaterialen voor andere organische syntheses, aangezien hun C = O-groep kan worden gereduceerd of nucleofiele additie kan ondergaan..
Artikel index
- 1 Chemische structuur
- 1.1 Positie-isomeren
- 1.2 Intermoleculaire interacties
- 1.3 Kristallen
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molaire massa
- 2.3 Dichtheid
- 2.4 Smeltpunt
- 2.5 Kookpunt
- 2.6 Oplosbaarheid in water
- 2.7 Dampspanning
- 2.8 Vlampunt
- 2.9 Stabiliteit
- 3 Synthese
- 3.1 2-pentanon
- 3.2 3-pentanon
- 4 toepassingen
- 5 referenties
Chemische structuur
Positie-isomeren
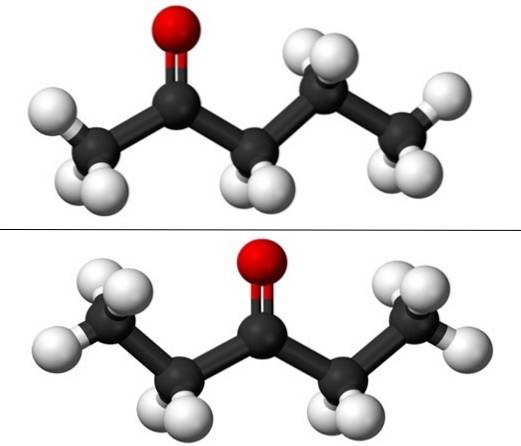
In de afbeelding hebben we de moleculaire structuren van de twee positionele isomeren voor pentanon, weergegeven door een model van bollen en staven. De zwarte bollen komen overeen met de koolstofskeletten, de witte met de waterstofatomen en de rode met de zuurstofatomen van de C = O-groep..
2-pentanon
Het 2-pentanon (hierboven) heeft de groep C = O in het tweede koolstofatoom, wat overeenkomt met de groep als het in het vierde koolstofatoom zou zijn; dat wil zeggen, 2-pentanon en 4-pentanon zijn equivalent, aangezien het voldoende is om ze 180 ° te draaien zodat hun structuren hetzelfde zijn.
Links van C = O staat een methylgroep, CH3-, en rechts van hem een propylradicaal. Daarom wordt dit keton ook wel (minder vaak gebruikt) methylpropylketon (MPK) genoemd. Je kunt de asymmetrie van deze structuur op het eerste gezicht zien.
3-pentanon
3-pentanon (onder) heeft de groep C = O op het derde koolstofatoom. Merk op dat dit isomeer een grotere versie van aceton is, en dat het ook erg symmetrisch is; de twee radicalen aan de zijkanten van de C = O-groep zijn hetzelfde: twee ethylradicalen, CH3CHtwee-. Dit is de reden waarom 3-pentanon ook diethylketon (of dimethylaceton) wordt genoemd.
Intermoleculaire interacties
De aanwezigheid van de carbonylgroep, zowel in 2-pentanon als in 3-pentanon, verleent polariteit aan het molecuul.
Daarom zijn beide isomeren van pentanon in staat om met elkaar in wisselwerking te staan door middel van dipool-dipoolkrachten, waarbij de hoogste dichtheid van negatieve lading, δ-, gezien in een elektrostatische potentiaalkaart, rond het zuurstofatoom zal worden georiënteerd..
Evenzo grijpen de Londense dispersiekrachten in mindere mate in tussen de verkoolde en gehydrogeneerde skeletten..
Omdat pentanon een groter molecuuloppervlak en een grotere massa heeft in vergelijking met aceton, draagt deze bijdrage bij aan het dipoolmoment en zorgt het ervoor dat het een hoger kookpunt heeft (102 ºC> 56 ºC). In feite verdampen de twee isomeren bij 102 ° C; terwijl het bij verschillende temperaturen vriest.
Kristallen
Waarschijnlijk spelen symmetrieën een belangrijke rol bij kristallisatie. Het smeltpunt van 2-pentanon is bijvoorbeeld -78 ºC, terwijl dat van 3-pentanon -39 ºC.
Dit betekent dat 3-pentanon-kristallen stabieler zijn tegen temperatuur; de moleculen zijn meer samenhangend en hebben meer warmte nodig om zich in de vloeistoffase te scheiden.
Als er een mengsel van beide isomeren zou zijn, zou het 3-pentanon als eerste kristalliseren, waarbij het 2-pentanon als laatste bij een lagere temperatuur zou zijn. De meer symmetrische 3-pentanon-moleculen oriënteren zich gemakkelijker dan die van 2-pentanon: asymmetrisch en tegelijkertijd dynamischer.
Eigendommen
Fysiek uiterlijk
Kleurloze vloeistoffen met een aroma dat lijkt op aceton.
Molaire massa
86,13 g / mol
Dichtheid
0,81 g / ml (3-pentanon)
0,809 g / ml (2-pentanon)
Smeltpunt
-78 ºC (2-pentanon)
-39 ºC (3-pentanon)
Kookpunt
102 ºC (voor beide isomeren)
Oplosbaarheid in water
35 g / l (3-pentanon)
60 g / l (2-pentanon)
Dampdruk
35 mmHg (3-pentanon)
270 mmHg (2-pentanon) bij 20 ° C
Deze waarden zijn niet bruikbaar om de dampspanningen van beide isomeren rechtstreeks te vergelijken, aangezien de eerste wordt gerapporteerd zonder de temperatuur waarbij deze werd gemeten..
Vlampunt
12,78 ° C (3-pentanon)
10 ºC (2-pentanon)
Stabiliteit
De twee isomeren van pentanon zijn zeer brandbaar, dus ze moeten zo ver mogelijk uit de buurt van warmtebronnen worden gehouden. De vlampunten geven aan dat een vlam de dampen van beide pentanonen kan ontsteken, zelfs bij een temperatuur van 10ºC..
Synthese
Hoewel de twee isomeren van pentanon fysisch en chemisch erg op elkaar lijken, zijn hun synthetische routes onafhankelijk van elkaar, dus het is onwaarschijnlijk dat beide in dezelfde synthese worden verkregen..
2-pentanon
Uitgaande van het reagens 2-pentanol, een secundaire alcohol, kan het worden geoxideerd tot 2-pentanon met in situ gevormd hypochloorzuur, HClO, als oxidatiemiddel. De oxidatie zou zijn:
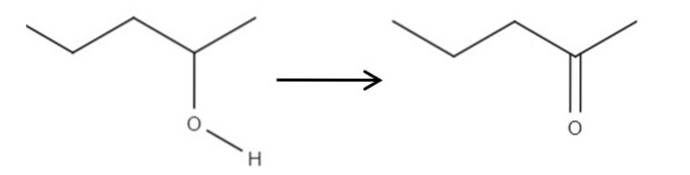
Gewoon de C-OH-binding wordt C = O. Er zijn andere methoden om 2-pentanon te synthetiseren, maar dit is het gemakkelijkst te begrijpen..
3-pentanon
3-pentanon kan worden gesynthetiseerd door ketonische decarboxylering van propaanzuur, CH3CHtweeCOOH. Deze synthetische route produceert symmetrische ketonen en bestaat uit een molecuul CH3COOH verliest de COOH-groep als COtwee, terwijl de andere zijn OH-groep in de vorm van HtweeOF:
2CH3CHtweeCOOH => CH3CHtweeAutotweeCH3 + COtwee + H.tweeOF
Een andere wat complexere route is om een mengsel van ethyleen, CH, direct te laten reagerentwee= CHtwee, COtwee en Htwee om 3-pentanon te vormen.
Toepassingen
Tenzij de toepassing erg rigoureus is, het een specifieke synthese is, of er ook is aangetoond dat de twee isomeren niet dezelfde resultaten opleveren, is het irrelevant om te kiezen tussen het gebruik van 2-pentanon of 3-pentanon voor elk van hun toepassingen..
Met andere woorden, "het maakt niet uit" of u 2-pentanon of 3-pentanon wilt gebruiken als oplosmiddel voor verf of harsen, of als ontvetter, aangezien de belangrijkste criteria de prijs en beschikbaarheid zijn. 3-pentanon wordt in de auto-industrie gebruikt om het gedrag van gassen in verbrandingsmotoren te bestuderen.
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Wikipedia. (2019). 3-pentanon. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2019). 2-pentanon. PubChem-database. CID = 7895. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2019). 3-pentanon. Hersteld van: chemspider.com
- Professor T. Nalli. (2013). Oxidatie van 2-pentanol en destillatie van het product. Hersteld van: course1.winona.edu



Niemand heeft nog op dit artikel gereageerd.