
Polariteit (chemie) polaire moleculen en voorbeelden
De chemische polariteit het is een eigenschap die wordt gekenmerkt door de aanwezigheid van een uitgesproken heterogene verdeling van elektronendichtheden in een molecuul. In zijn structuur zijn er daarom negatief geladen gebieden (δ-) en andere positief geladen (δ +), die een dipoolmoment genereren.
Het bindingsdipoolmoment (µ) is een manier om de polariteit van een molecuul uit te drukken. Het wordt meestal weergegeven als een vector waarvan de oorsprong in de lading (+) ligt en het uiteinde zich in de lading (-) bevindt, hoewel sommige chemici het omgekeerd weergeven.
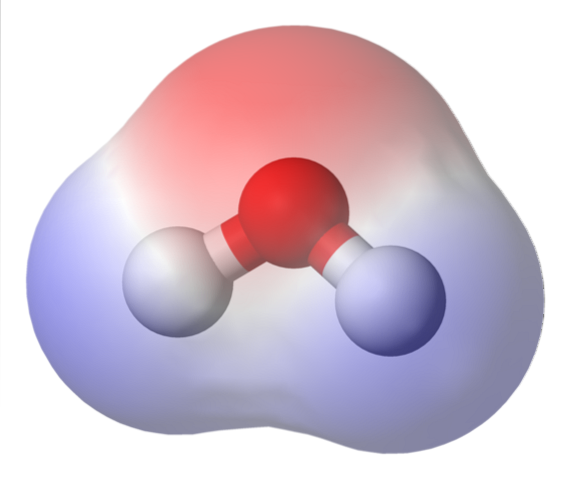
De bovenste afbeelding toont de elektrostatische potentiaalkaart voor water, H.tweeO. Het roodachtige gebied (zuurstofatoom) komt overeen met het gebied met de hoogste elektronendichtheid, en het is ook te zien dat het opvalt boven de blauwe gebieden (waterstofatomen).
Omdat de verdeling van deze elektronendichtheid heterogeen is, wordt er gezegd dat er een positieve en een negatieve pool is. Daarom is er sprake van chemische 'polariteit' en dipoolmoment.
Artikel index
- 1 dipoolmoment
- 1.1 Asymmetrie in het watermolecuul
- 2 polaire moleculen
- 3 voorbeelden
- 3.1 SO2
- 3,2 CHC13
- 3.3 HF
- 3,4 NH3
- 3.5 Macromoleculen met heteroatomen
- 4 referenties
Dipool moment
Het dipoolmoment µ wordt bepaald door de volgende vergelijking:
µ = δd
Waar δ de elektrische lading van elke pool is, positief (+ δ) of negatief (-δ), en d is de afstand tussen hen.
Het dipoolmoment wordt meestal uitgedrukt in debye, weergegeven door het symbool D. Een coulomb · meter is gelijk aan 2.998 · 1029 D.
De waarde van het dipoolmoment van de binding tussen twee verschillende atomen staat in relatie tot het verschil in elektronegativiteiten van de atomen die de binding vormen..
Om een molecuul polair te laten zijn, is het niet voldoende om polaire bindingen in zijn structuur te hebben, maar het moet ook een asymmetrische geometrie hebben; zodanig dat het voorkomt dat de dipoolmomenten elkaars vectoren opheffen.
Asymmetrie in het watermolecuul
Het watermolecuul heeft twee O-H-bindingen. De geometrie van het molecuul is hoekig, dat wil zeggen in de vorm van een "V"; dus de dipoolmomenten van de bindingen heffen elkaar niet op, maar de som ervan wordt geproduceerd wijzend naar het zuurstofatoom.
De elektrostatische potentiaalkaart voor HtweeOf reflecteer dit.
Als het hoekmolecuul H-O-H wordt waargenomen, kan de volgende vraag rijzen: is het echt asymmetrisch? Als een denkbeeldige as door het zuurstofatoom wordt getrokken, zal het molecuul zich in twee gelijke helften verdelen: H-O | O-H.
Maar dat is niet zo als de denkbeeldige as horizontaal is. Als deze as het molecuul nu weer in twee helften verdeelt, hebben we aan de ene kant het zuurstofatoom en aan de andere kant de twee waterstofatomen..
Om deze reden is de schijnbare symmetrie van de HtweeOf het houdt op te bestaan en wordt daarom als een asymmetrisch molecuul beschouwd.
Polaire moleculen
Polaire moleculen moeten voldoen aan een reeks kenmerken, zoals:
-De verdeling van elektrische ladingen in de moleculaire structuur is asymmetrisch.
-Ze zijn meestal oplosbaar in water. Dit komt omdat polaire moleculen kunnen interageren door dipool-dipoolkrachten, waarbij water wordt gekenmerkt door een groot dipoolmoment.
Bovendien is de diëlektrische constante erg hoog (78,5), waardoor het de elektrische ladingen gescheiden kan houden, waardoor de oplosbaarheid toeneemt..
-Over het algemeen hebben polaire moleculen hoge kook- en smeltpunten.
Deze krachten worden gevormd door de dipool-dipool interactie, de Londense dispersiekrachten en de vorming van waterstofbruggen..
-Vanwege hun elektrische lading kunnen polaire moleculen elektriciteit geleiden.
Voorbeelden
SWtwee
Zwaveldioxide (SOtweeZuurstof heeft een elektronegativiteit van 3,44, terwijl de elektronegativiteit van zwavel 2,58 is. Daarom is zuurstof meer elektronegatief dan zwavel. Er zijn twee S = O-bindingen, de O heeft een δ-lading en de S a δ-lading+.
Omdat het een hoekmolecuul is met S op de top, zijn de twee dipoolmomenten in dezelfde richting georiënteerd; en daarom tellen ze op, waardoor het SO-molecuul ontstaattwee wees polair.
CHCl3
Chloroform (HCCl3Er is één C-H-binding en drie C-Cl-bindingen.
De elektronegativiteit van C is 2,55 en de elektronegativiteit van H is 2,2. Koolstof is dus elektronegatiever dan waterstof; en daarom zal het dipoolmoment georiënteerd zijn van H (δ +) naar C (δ-): Cδ--H.δ+.
In het geval van C-Cl-bindingen heeft C een elektronegativiteit van 2,55, terwijl Cl een elektronegativiteit van 3,16 heeft. De dipoolvector of dipoolmoment is georiënteerd van C naar Cl in de drie C-bindingen δ+-Cl δ-.
Omdat er een elektronenarm gebied is, rond het waterstofatoom, en een elektronenrijk gebied dat bestaat uit de drie chlooratomen, CHCl3 wordt beschouwd als een polair molecuul.
HF
Waterstoffluoride heeft slechts één H-F-binding. De elektronegativiteit van H is 2,22 en de elektronegativiteit van F is 3,98. Daarom krijgt fluor de hoogste elektronendichtheid en kan de binding tussen beide atomen het beste worden omschreven als: Hδ+-F.δ-.
NH3
Ammoniak (NH3) heeft drie NH-bindingen. De elektronegativiteit van N is 3,06 en de elektronegativiteit van H is 2,22. In alle drie de bindingen is de elektronendichtheid gericht op stikstof, en is zelfs hoger door de aanwezigheid van een paar vrije elektronen.
Het NH-molecuul3 het is tetraëdrisch, waarbij het N-atoom het hoekpunt bezet. De drie dipoolmomenten, die overeenkomen met de NH-bindingen, zijn in dezelfde richting georiënteerd. Daarin bevindt δ- zich in de N en δ + in de H. De bindingen zijn dus: Nδ--H.δ+.
Deze dipoolmomenten, de asymmetrie van het molecuul en het vrije elektronenpaar op stikstof maken van ammoniak een sterk polair molecuul..
Macromoleculen met heteroatomen
Wanneer de moleculen erg groot zijn, is het niet langer zeker om ze zelf als apolair of polair te classificeren. Dit komt omdat er delen van de structuur kunnen zijn met zowel apolaire (hydrofobe) als polaire (hydrofiele) eigenschappen..
Deze soorten verbindingen staan bekend als amfifielen of amfipaten. Omdat het apolaire deel als elektronenarm kan worden beschouwd ten opzichte van het polaire deel, is er een polariteit aanwezig in de structuur en worden amfifiele verbindingen beschouwd als polaire verbindingen..
Van een macromolecuul met heteroatomen kan in het algemeen worden verwacht dat het dipoolmomenten heeft, en dus chemische polariteit..
Heteroatomen worden beschouwd als die welke verschillen van die waaruit het skelet van de structuur bestaat. Zo is het koolstofskelet biologisch het belangrijkste van allemaal en wordt het atoom waarmee koolstof een binding vormt (naast waterstof) een heteroatoom genoemd..
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Prof. Krishnan. (2007). Polaire en niet-polaire verbindingen. St. Louis Community College. Hersteld van: users.stlcc.edu
- Murmson, Serm. (14 maart 2018). Polariteit uitleggen. Wetenschappelijk. Hersteld van: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (5 december 2018). Polar Bond-definitie en voorbeelden (Polar Covalent Bond). Hersteld van: thoughtco.com
- Wikipedia. (2019). Chemische polariteit. Hersteld van: en.wikipedia.org
- Quimitube. (2012). Covalente binding: bindingspolariteit en moleculaire polariteit. Hersteld van: quimitube.com



Niemand heeft nog op dit artikel gereageerd.