
Wat zijn de Van der Waals-krachten?
De Van der Waals krachten het zijn intermoleculaire krachten van elektrische aard die aantrekkelijk of afstotend kunnen zijn. Er is een interactie tussen de oppervlakken van de moleculen of atomen, die in wezen verschilt van de ionische, covalente en metalen bindingen die in de moleculen worden gevormd..
Hoewel ze zwak zijn, zijn deze krachten in staat gasmoleculen aan te trekken; ook die van vloeibaar gemaakte en gestolde gassen en die van alle organische vloeistoffen en vaste stoffen. Johannes van der Waals (1873) was degene die een theorie ontwikkelde om het gedrag van echte gassen te verklaren.

In de zogenaamde Van der Waals-vergelijking voor echte gassen - (P. + naarntwee/ Vtwee) (V - nb)) = nRT - twee constanten worden geïntroduceerd: de constante b (dat wil zeggen, het volume ingenomen door de gasmoleculen) en "a", wat een empirische constante is.
De constante "a" corrigeert de afwijking van het verwachte gedrag van ideale gassen bij lage temperaturen, precies daar waar de aantrekkingskracht tussen de gasmoleculen wordt uitgedrukt. Het vermogen van een atoom om te polariseren in het periodiek systeem neemt toe van de bovenkant van een groep naar de onderkant van de groep, en van rechts naar links over een periode..
Door het atoomnummer - en dus het aantal elektronen - te verhogen, zijn degenen die zich in de buitenste schillen bevinden gemakkelijker te verplaatsen om polaire elementen te vormen.
Artikel index
- 1 Intermoleculaire elektrische interacties
- 1.1 Interactie tussen permanente dipolen
- 1.2 Interactie tussen een permanente dipool en een geïnduceerde dipool
- 2 Londense troepen of verstrooiing
- 3 Van der Waals radio's
- 4 Krachten en energie van de elektrische interactie tussen atomen en tussen moleculen
- 5 referenties
Intermoleculaire elektrische interacties
Interactie tussen permanente dipolen
Er zijn elektrisch neutrale moleculen, dit zijn permanente dipolen. Dit komt door een verstoring in de elektronische distributie die een ruimtelijke scheiding veroorzaakt van de positieve en negatieve ladingen naar de uiteinden van het molecuul, waardoor een dipool wordt gevormd (alsof het een magneet is).
Water bestaat uit 2 waterstofatomen aan het ene uiteinde van het molecuul en een zuurstofatoom aan het andere uiteinde. Zuurstof heeft een hogere affiniteit voor elektronen dan waterstof en trekt ze aan.
Hierdoor ontstaat een verplaatsing van elektronen richting zuurstof, deze negatief geladen en waterstof met een positieve lading..

De negatieve lading van een watermolecuul kan elektrostatisch interageren met de positieve lading van een ander watermolecuul, wat een elektrische aantrekkingskracht veroorzaakt. Dit type elektrostatische interactie wordt dus Keesom-krachten genoemd.
Interactie tussen een permanente dipool en een geïnduceerde dipool
De permanente dipool heeft een zogenaamd dipoolmoment (µ). De grootte van het dipoolmoment wordt gegeven door de wiskundige uitdrukking:
µ = q.x
q = elektrische lading.
x = ruimtelijke afstand tussen de polen.
Het dipoolmoment is een vector die, volgens afspraak, georiënteerd wordt weergegeven van de negatieve pool naar de positieve pool. De omvang van µ doet pijn om uit te drukken in debye (3.34 × 10-30 Cm.
De permanente dipool kan een interactie aangaan met een neutraal molecuul waardoor de elektronische distributie verandert, wat resulteert in een geïnduceerde dipool in dit molecuul.
De permanente dipool en de geïnduceerde dipool kunnen elektrisch interageren, waardoor een elektrische kracht ontstaat. Dit type interactie staat bekend als inductie en de krachten die erop inwerken, worden Debye-krachten genoemd..
Londense troepen of verstrooiing
De aard van deze aantrekkingskracht wordt verklaard door de kwantummechanica. London stelde dat in elektrisch neutrale moleculen het centrum van de negatieve ladingen van de elektronen en het centrum van de positieve ladingen van de kernen in een oogwenk misschien niet samenvallen..
Door de fluctuatie van de elektronendichtheid kunnen de moleculen zich dus gedragen als tijdelijke dipolen.
Dit is op zichzelf geen verklaring voor aantrekkingskrachten, maar tijdelijke dipolen kunnen juist uitgelijnde polarisatie van aangrenzende moleculen induceren, wat resulteert in het genereren van een aantrekkingskracht. De aantrekkende krachten die worden gegenereerd door elektronische fluctuaties worden Londense krachten of dispersie genoemd..
Van der Waals-krachten vertonen anisotropie en worden daarom beïnvloed door de oriëntatie van de moleculen. Interacties van het dispersietype zijn echter altijd overwegend aantrekkelijk..
Londense krachten worden sterker naarmate de grootte van de moleculen of atomen toeneemt.
In halogenen, de F-moleculentwee en Cltwee lage atoomnummers zijn gassen. De BRtwee met het hoogste atoomnummer is een vloeistof en de iktwee, het halogeen met het hoogste atoomnummer is bij kamertemperatuur een vaste stof.
Door het atoomnummer te verhogen, neemt het aantal aanwezige elektronen toe, wat de polarisatie van de atomen en dus de interacties daartussen vergemakkelijkt. Dit bepaalt de fysieke toestand van de halogenen.
Van der Waals radio's
De interacties tussen moleculen en tussen atomen kunnen aantrekkelijk of afstotelijk zijn, afhankelijk van een kritische afstand tussen hun centra, die r wordt genoemd.v.
Op afstanden tussen moleculen of atomen groter dan rv, de aantrekkingskracht tussen de kernen van het ene molecuul en de elektronen van het andere overheerst boven de afstotingen tussen de kernen en de elektronen van de twee moleculen.
In het beschreven geval is de interactie aantrekkelijk, maar wat gebeurt er als de moleculen dichterbij komen op een afstand tussen hun centra die kleiner is dan rv? Dan overheerst de afstotende kracht boven de aantrekkelijke, die een nauwere nadering tussen de atomen tegenwerkt..
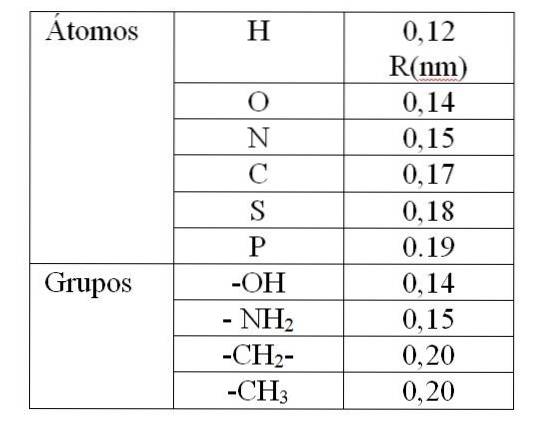
De waarde van rv Het wordt gegeven door de zogenaamde Van der Waals-stralen (R). Voor bolvormige en identieke moleculen rv is gelijk aan 2R. Voor twee verschillende moleculen met stralen R1 en Rtwee: rv is gelijk aan R1 + Rtwee. De waarden van de Van der Waals-stralen worden gegeven in tabel 1.
De waarde in tabel 1 geeft een Van der Waals-straal aan van 0,12 nm (10-9 m) voor waterstof. Dan is de waarde van rv voor dit atoom is het 0,24 nm. Voor een waarde van rv minder dan 0,24 nm zal een afstoting veroorzaken tussen de waterstofatomen.
Krachten en energie van de elektrische interactie tussen atomen en tussen moleculen
De kracht tussen een paar ladingen q1 en wattwee, gescheiden in een vacuüm door de afstand r, wordt gegeven door de wet van Coulomb.
F = k. wat1.wattwee/ rtwee
In deze uitdrukking is k een constante waarvan de waarde afhangt van de gebruikte eenheden. Als de waarde van de kracht - gegeven door de toepassing van de wet van Coulomb - negatief is, duidt dit op een aantrekkingskracht. Als de waarde die voor de kracht wordt gegeven daarentegen positief is, duidt dit op een afstotende kracht.
Omdat de moleculen zich meestal in een waterig medium bevinden dat de uitgeoefende elektrische krachten afschermt, is het noodzakelijk om de term diëlektrische constante (ε) te introduceren. Deze constante corrigeert dus de waarde die wordt gegeven voor de elektrische krachten door toepassing van de wet van Coulomb.
F = k.q1.wattwee/ε.rtwee
Evenzo wordt de energie voor de elektrische interactie (U) gegeven door de uitdrukking:
U = k. wat1.wattwee/ε.r
Referenties
- De redactie van Encyclopaedia Britannica. (2018). Van der Waals krachten. Opgehaald op 27 mei 2018, van: britannica.com
- Wikipedia. (2017). Van der Waals krachten. Opgehaald op 27 mei 2018, van: es.wikipedia.org
- Kathryn Rashe, Lisa Peterson, Seila Buth, Irene Ly. Van der Waals strijdkrachten. Opgehaald op 27 mei 2018, van: chem.libretexts.org
- Morris, J. G. (1974) Fysische chemie van een bioloog. 2en editie. Edward Arnold (uitgevers) Limited.
- Mathews, C. K., Van Holde, K.E. en Ahern, K.G. (2002) Biochemie. Derde editie. Addison Wesley Longman, Inc..



Niemand heeft nog op dit artikel gereageerd.