
Endotherme en exotherme reactie

EEN endotherme reactie vereist stroom terwijl een exotherme reactie geeft energie vrij. Deze classificatie van chemische reacties houdt rekening met de deelname van energie als reactant of als product..
Energie is het vermogen om te werken of om warmte te produceren. Onthoud dat chemische reacties een reorganisatie van atomen tussen stoffen met zich meebrengen met breuk of vorming van chemische bindingen. In het algemeen gaat deze vorming of verbreking van chemische bindingen gepaard met veranderingen in de energie van het systeem..
| Endotherme reactie | Exotherme reactie | |
|---|---|---|
| Definitie | Chemische reactie waarbij energie wordt geabsorbeerd. | Chemische reactie waarbij energie vrijkomt in de vorm van warmte. |
| Herkomst van energie | Van het milieu | Van het systeem |
| Potentiële energie | Lager in reactanten dan in producten. | Groter in reactanten dan in producten. |
| Productie | Niet spontaan | Spontaan |
| Interne energieverandering | AE> 0; interne energieverandering groter dan nul. | ΔE<0; cambio de energía interna menor que cero. |
| Temperatuur | Verlaagt | Verhoogt |
| Voorbeelden | Reacties in fotosynthese en synthese in het algemeen. | Een brandende lucifer, verbrandingsreacties. |
Wat is een endotherme reactie?
Een chemische reactie is endotherm wanneer absorbeert energie uit de omgeving. In dit geval wordt de warmte van buiten naar binnen overgebracht. Als we een thermometer plaatsen terwijl de endotherme reactie plaatsvindt, daalt de temperatuur.
Het woord "endotherm" is afgeleid van het Grieks eindigt op wat betekent "binnen" en therme wat "warmte" betekent. Endotherme reacties verlopen niet spontaan.
Waar komt de energie vandaan bij endotherme reacties?
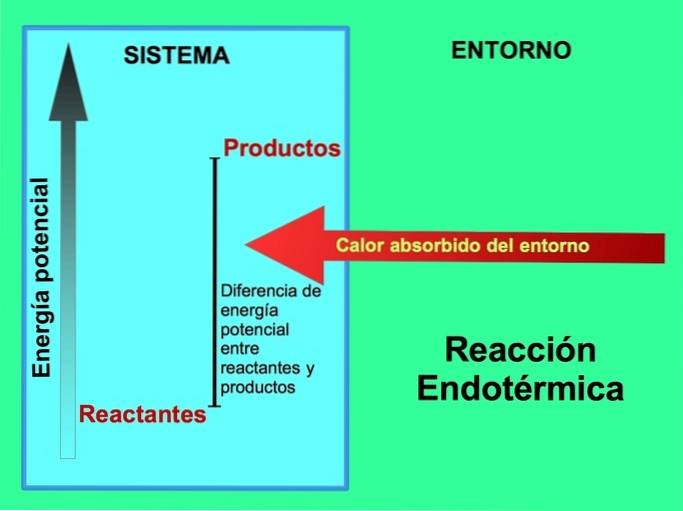
Bij endotherme reacties komt de energie uit de omgeving buiten het systeem. De hoeveelheid potentiële energie van de producten is groter dan de potentiële energie van de reactanten. Daarom is het nodig om energie aan de reactanten toe te voegen om de reactie te laten verlopen. Deze energie komt uit de warmte van de omgeving.
Bijvoorbeeld, fotosynthese is een endotherm proces, waar planten zonne-energie opvangen om glucose te produceren uit kooldioxide en zuurstof:

De producten van de fotosynthesereactie, glucose en zuurstof, hebben een grotere hoeveelheid potentiële energie ten opzichte van de reactanten, kooldioxide en water. Andere voorbeelden van endotherme chemische reacties met de hoeveelheid gebruikte energie:

Voorbeelden van endotherme reacties
Niet alleen in het scheikundig laboratorium treden reacties op. In de dagelijkse praktijk vinden we ook situaties waarin endotherme reacties optreden.
Eten koken
Hoewel het misschien niet zo lijkt, is het koken van voedsel endotherm. Om bepaalde voedingsmiddelen te consumeren, moeten we voor warmte zorgen.
Instant koude zak
Koudverpakkingen die worden gebruikt om stoten of verstuikingen te behandelen, worden gevuld met water, maar wanneer ze worden geschud of gestoten, breekt een capsule met ammoniumnitraat binnenin. Het mengen van ammoniumnitraat met water is een endotherme reactie, waardoor de zak afkoelt.
Wat is een exotherme reactie?
EEN exotherme reactie is er een waarbij energie uit het systeem stroomt. Deze energie komt vrij in de vorm van warmte, dus het plaatsen van een thermometer in het reactiesysteem verhoogt de temperatuur.
Het woord "exotherm" wordt gevormd door exo wat betekent "naar buiten" en thermes, wat "warmte" betekent. Exotherme reacties kunnen spontaan optreden en in sommige gevallen explosief zijn, zoals de combinatie van alkalimetalen en water.
Waar komt de energie vandaan bij exotherme reacties?
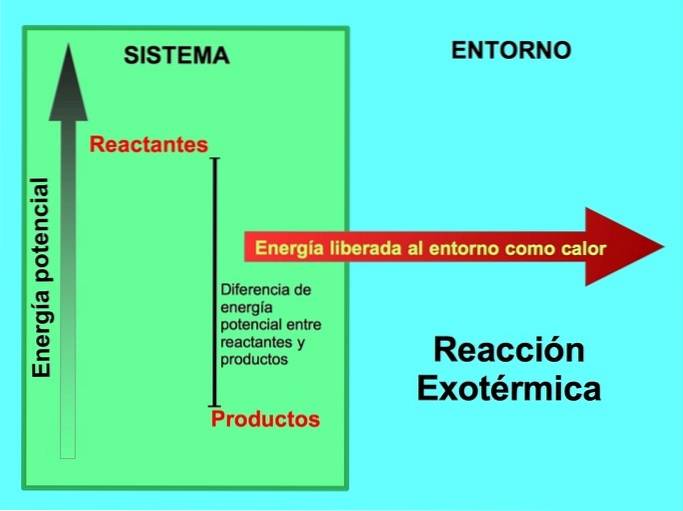
In een chemische reactie zijn reactanten de verbindingen die transformeren en producten voortbrengen. Als natrium Na bijvoorbeeld reageert met chloor Cl, zijn dit de reactanten en is het product natriumchloride NaCl:
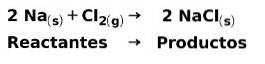
Zowel reactanten als producten hebben potentiële energie opgeslagen. We weten van de lenergiebesparing ey die energie gaat niet verloren of gewonnen, dus de energie van de reactanten moet gelijk zijn aan die van de producten.
In een exotherme reactie, lreactanten hebben meer potentiële energie in vergelijking met producten, dus de overtollige energie komt vrij als warmte. In dit geval wordt energie ook als onderdeel van de producten beschouwd:

Bij elk exotherm proces wordt een deel van de potentiële energie die is opgeslagen in chemische bindingen via warmte omgezet in thermische energie..
Voorbeelden van exotherme reacties
Wasmiddel
Als we een beetje waspoeder oplossen met water in onze handen, voelen we een lichte opwarming.
Verbranding van huishoudelijk gas
De verbranding van gassen voor huishoudelijk gebruik, zoals methaan of butaan, omvat de chemische reactie met zuurstof onder vorming van kooldioxide en water, en het vrijkomen van energie. Dit is een typische exotherme reactie bij dagelijks gebruik:
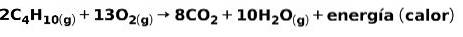
De energie die vrijkomt bij het verbrandingsproces wordt gebruikt om voedsel te koken.
Mogelijk bent u ook geïnteresseerd in wat zijn Open systeem, gesloten systeem en geïsoleerd systeem.


Niemand heeft nog op dit artikel gereageerd.