
Insulinereceptorkarakteristieken, structuur, functies
De insulinereceptoren Het zijn eiwitstructuren die worden blootgesteld aan de extracellulaire kant van het plasmamembraan van veel cellen van het menselijk lichaam en dat van andere zoogdieren. De natuurlijke ligand van deze receptor is insuline.
Insuline is een hormoon dat wordt gesynthetiseerd door de ß-cellen van de eilandjes van Langerhans van het endocriene deel van de pancreas, een orgaan in de buikholte dat spijsverteringsenzymen en hormonen synthetiseert..
De insuline die door de alvleesklier wordt gesynthetiseerd en afgegeven, bindt zich aan zijn receptor op het plasmamembraan van de doelcellen en als gevolg van deze ligand-receptorbinding wordt een reeks intracellulaire processen geactiveerd die uiteindelijk de opname van glucose in de cellen bevorderen..
Insuline is verantwoordelijk voor de activering van vele anabole of synthetische reacties die verband houden met het metabolisme van koolhydraten, vetten en eiwitten..
Insulinereceptoren zijn glycoproteïnen gevormd door vier subeenheden met hun amino- en carboxyl-terminale delen in het cytoplasmatische gebied. Wanneer deze receptoren aan insuline binden, klonteren ze samen en vormen ze endocyten.
Bij obesitas en diabetes type II is het aantal insulinereceptoren afgenomen en dit verklaart gedeeltelijk de insulineresistentie die gepaard gaat met deze pathologische aandoeningen.
Artikel index
- 1 Kenmerken
- 2 Structuur
- 3 functies
- 4 ziekten
- 5 referenties
Kenmerken
Insulinereceptoren maken deel uit van een familie van membraanreceptoren die bindingsplaatsen hebben voor hormonen van eiwitachtige aard. Dit type hormonen kan de celmembranen niet passeren, dus hun metabolische effecten worden uitgevoerd via hun receptoren..
Insuline is een peptidehormoon dat verband houdt met de bevordering van synthetische reacties die gezamenlijk anabole reacties worden genoemd en die verband houden met het metabolisme van koolhydraten, vetten en eiwitten..
Veel cellen hebben insulinereceptoren, voornamelijk spiercellen, levercellen en vetweefselcellen. Andere cellen die klaarblijkelijk geen insuline-doelwitcellen zijn, bezitten echter ook insulinereceptoren..
Het binnendringen van glucose in cellen, in sommige weefsels, is afhankelijk van insuline, aangezien daarin de eiwitten die verantwoordelijk zijn voor de vergemakkelijkte diffusie van glucose worden aangetroffen in kleine stukjes membraan die intracellulaire blaasjes vormen..
Wanneer insuline zich bindt aan zijn receptor in dit type insuline-afhankelijke cellen, bewegen de glucosetransporters in de intracellulaire blaasjes en verschijnen ze op het oppervlak van het celmembraan wanneer deze blaasjes samensmelten met dit membraan..
Onder andere de skeletspier- en vetweefselcellen zijn een voorbeeld van dit mechanisme.
Insulinereceptoren hebben een relatief korte halfwaardetijd van ongeveer 7 tot 12 uur, dus ze worden constant gesynthetiseerd en afgebroken. Bij zoogdieren is de receptorconcentratie ongeveer 20.000 receptoren per cel..
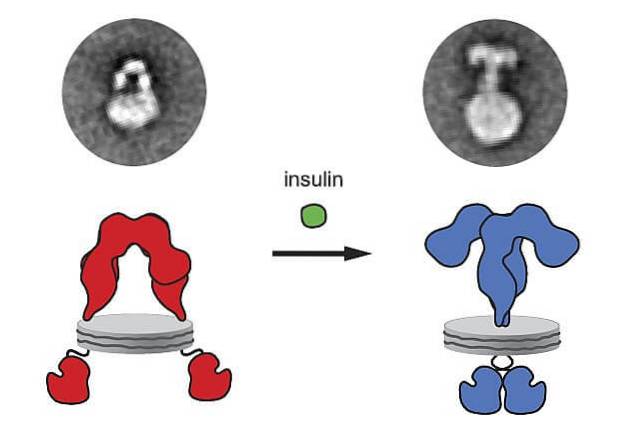
Wanneer insuline aan de receptor bindt, treedt een conformatieverandering van de receptor op, aangrenzende receptoren bewegen, worden microaggregaten geproduceerd en vervolgens wordt de receptor geïnternaliseerd. Tegelijkertijd worden de signalen gegenereerd die de reacties versterken..
Structuur
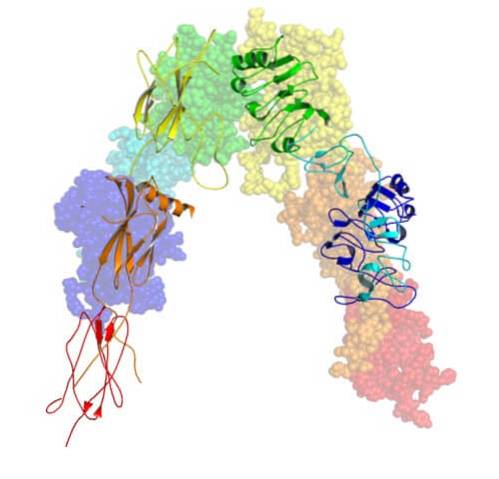
Het gen dat codeert voor de insulinereceptor bevindt zich op chromosoom 19 en heeft 22 exons. Deze receptor bestaat uit vier disulfide-gekoppelde glycoproteïne-subeenheden..
Het wordt aanvankelijk in het endoplasmatisch reticulum gesynthetiseerd als een enkele polypeptideketen van ongeveer 1.382 aminozuren die vervolgens wordt gefosforyleerd en gesplitst om de α- en β-subeenheden te vormen..
De vier subeenheden van de insulinereceptor zijn twee alfa's (α) met een molecuulgewicht van 140.000 Da en twee kleinere bèta's (β), met een molecuulgewicht van ongeveer 95.000 Da.
De α-subeenheden zijn extracellulair en worden blootgesteld aan het buitenoppervlak van het celmembraan. De β-subeenheden daarentegen doorkruisen het membraan en steken bloot aan of steken uit op het binnenoppervlak van het membraan (tegenover het cytoplasma).
De α-subeenheden bevatten de bindingsplaats voor insuline. In de β-eenheden is er een bindingsplaats voor ATP die de kinasefunctie van deze subeenheid activeert en receptor-autofosforylering induceert op de tyrosineresiduen van de β-subeenheid..
Deze receptoren maken deel uit van een familie van receptoren die geassocieerd zijn met cytoplasmatische enzymen zoals tyrosine-kinase, een enzym dat wordt geactiveerd wanneer insuline aan de receptor bindt en een proces van fosforylering en defosforylering van een reeks enzymen op gang brengt die verantwoordelijk zullen zijn voor de effecten. insuline metabolisch.
Kenmerken
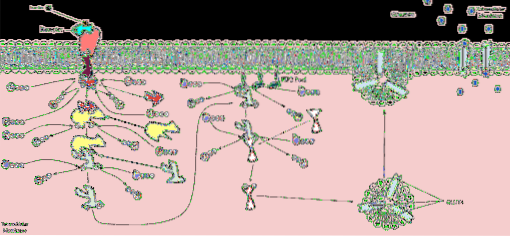
De α-subeenheid van insulinereceptoren heeft de bindingsplaats voor insuline. Wanneer deze eenheid aan zijn ligand bindt, treden conformatieveranderingen op in de receptorstructuur die de β-subeenheden activeren die verantwoordelijk zijn voor de signaaltransductiemechanismen en dus voor de effecten van insuline..
In de cytoplasmatische domeinen van de receptor wordt een tyrosinekinase geactiveerd dat de transmissie van signalen door een cascade van kinasen initieert. Het eerste dat gebeurt, is de fosforylering of autofosforylering van de insulinereceptor en vervolgens worden de zogenaamde insulinereceptorsubstraten of IRS gefosforyleerd..
Vier insulinereceptorsubstraten genaamd IRS-1, IRS-2, IRS-3 en IRS-4 zijn beschreven. Hun fosforylering vindt plaats bij tyrosine-, serine- en threonineresiduen. Elk van deze substraten is gerelateerd aan verschillende kinasecascades die betrokken zijn bij de metabole effecten van insuline..
Bijvoorbeeld:
- IRS-1 lijkt verband te houden met het effect van insuline op celgroei.
- IRS -2 zijn gerelateerd aan de metabolische effecten van het hormoon, zoals verhoogde synthese van glycogeen, lipiden en eiwitten, en met de translocatie van eiwitten zoals receptoreiwitten en glucosetransporteiwitten..
Ziekten
Diabetes is een ziekte die een zeer hoog percentage van de wereldbevolking treft en die verband houdt met defecten in de productie van insuline, maar ook met een gebrekkige functie van insulinereceptoren..
Er zijn twee soorten diabetes: type I diabetes of juveniele diabetes, die insulineafhankelijk is, en type II diabetes of diabetes bij volwassenen, die niet insulineafhankelijk is..
Type I-diabetes is te wijten aan onvoldoende insulineproductie en wordt in verband gebracht met hyperglycemie en ketoacidose. Type II-diabetes is gerelateerd aan genetische factoren die zowel de insulineproductie als de receptorfunctie beïnvloeden en is geassocieerd met hyperglycemie zonder ketoacidose.
Referenties
- American Diabetes Association. (2010). Diagnose en classificatie van diabetes mellitus. Diabeteszorg, 33 (supplement 1), S62-S69.
- Berne, R., & Levy, M. (1990). Fysiologie. Mosby; Internationale Ed-editie.
- Fox, S. I. (2006). Menselijke fysiologie (9e ed.). New York, VS: McGraw-Hill Press.
- Guyton, A., & Hall, J. (2006). Textbook of Medical Physiology (11e ed.). Elsevier Inc..
- Lee, J., & Pilch, P. F. (1994). De insulinereceptor: structuur, functie en signalering. American Journal of Physiology-Cell Physiology, 266 (2), C319-C334.



Niemand heeft nog op dit artikel gereageerd.